
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )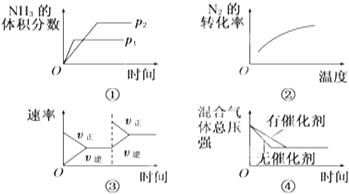
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
【答案】C
【解析】A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A不符合题意;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B不符合题意;
C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C符合题意;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D不符合题意;
故答案为:C.
根据温度、压强、浓度、催化剂等对化学反应速率和化学平衡的影响进行判断即可.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
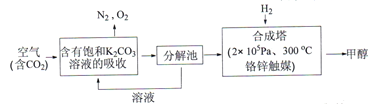
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
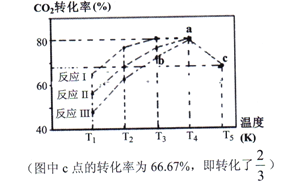
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法不正确的是
A. 0.1 mol BaCl2中所含离子总数为0.3 NA
B. 25℃时,0.1mol/L的HCl溶液中含有H+的数目为0.1 NA
C. 标准状况下,17 g H2O2中所含分子总数为0.5 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.只含有共价键的物质属于共价化合物
B.吸热反应不一定需要加热才能发生
C.含有离子键的物质肯定含金属元素
D.所有物质中均含有化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个原电池总反应为Zn+Cu2+=Zn2++Cu,该电池电极材料及电解质溶液可能是 ( )
选项 | 正极 | 负极 | 电解质溶液 |
A | Zn | Cu | CuCl2 |
B | Zn | Cu | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Zn | Ag | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精和醋酸是生活里的常用品,下列方法不能将二者鉴别开的是( )
A.闻气味
B.分别用来浸泡水壶中的水垢看是否溶解
C.分别滴加NaOH溶液
D.分别滴加石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)
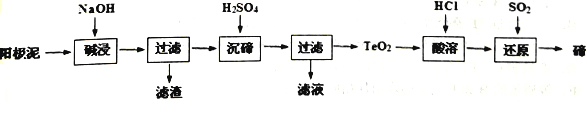
下列有关说法不正确的是
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理IKg这种阳极泥最少需通入标准状况下SO220.16L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1molMg | 6mol/L硝酸 | 10mL | 60℃ |
B | 0.1molMg | 3mol/L盐酸 | 10mL | 60℃ |
C | 0.1molFe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1molMg | 3mol/L盐酸 | 10mL | 30℃ |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com