
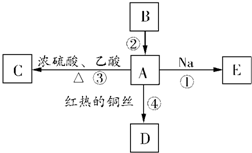
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
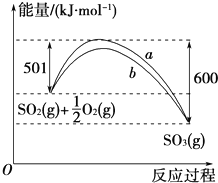 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往CH3COOH溶液中加水,c(OH-)和c(H+)均增大 |
| B、物质的量浓度均为0.1mol?1-1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)>(CH3COO-) |
| C、某浓度的氯化铵溶液中存在c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com