
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中Z单质的沸点最高
B.X和W的常见单质的分子式分别为X2和W2
C.W的氢化物沸点比X的氢化物的沸点低
D.R最高氧化物水化物的酸性最强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应的化学方程式为X(g)+Y(g) ![]() Z(g)
Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应开始到10 s,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. ![]()
(1)该微粒是中性微粒,这种微粒的符号是
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式:
(3)该微粒的还原性很弱,失去2个电子后变成原子,该元素在周期表中的位置为
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的化学方程式 .
(5)该微粒的符号为X3﹣ , 则这种微粒的单质的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镁可用于制造合金、储氢材料、镁电池等。
已知:C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol;
O2(g)=CO(g) △H=-110.5kJ/mol;
Mg(g)+ ![]() O2(g)=MgO(s)△H=-732.7kJ/mol。
O2(g)=MgO(s)△H=-732.7kJ/mol。
(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=____________。
(2)一种用水氯镁石(主要成分为MgC12·6H2O)制各金属镁工艺的关键流程如下:

①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为_____。“一段脱水”的目的是制备MgC12·2H2O,温度不高于180℃的原因是_______________。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为_________________。
③该工艺中,可以循环使用的物质有_______________。
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2(标准状况下)生成X,X的化学式为______________。
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体. 
请回答下列问题:
(1)E的化学式为 .
(2)A的电子式为 .
(3)写出反应①的离子方程式: .
(4)写出反应②的化学方程式,并标出电子转移的方向与数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的值为NA,下列有关微粒间关系正确的是
A.1 mol SO42-带2NA个负电荷B.1 mol Ne中含有20NA个质子
C.1 mol 氮中含有NA个N2D.1 mol H+中含有NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 0.1mol·L-1 Na2SO3溶液加水稀释,c(H+)∶c(SO![]() )的值逐渐减小
)的值逐渐减小
B. pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol·L-1
C. pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性
D. 把0.2mol·L-1醋酸与0.1mol·L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到Cl2的集气瓶中.你认为甲同学在实验中应该观察到的现象是 .
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图1、2所示的实验,请你指出其中的两处错误:、;纠正上述错误后,请你从绿色化学的角度出发,对图2装置提出改进建议,使装置既能控制反应的进行,又能减少氮氧化物的排放: . 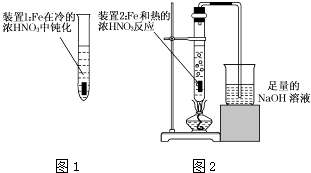
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解(Cu有剩余). ①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是 .
②丁同学认为丙同学的结论不完全正确.他的理由是 .
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+ . 说明具体的操作和实验现象 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com