
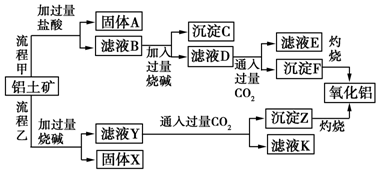
分析 由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,结合题目分析解答.
解答 解:由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
(1)氧化铝、氧化铁、MgO分别和酸反应生成盐和水,离子方程式分别为Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O、MgO+2H+═Mg2++H2O,
故答案为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;MgO+2H+═Mg2++H2O;
(2)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)沉淀C的成分是Mg(OH)2、Fe(OH)3,分离难溶性固体和溶液采用过滤方法,所以除去沉淀C采用过滤方法,
故答案为:Mg(OH)2、Fe(OH)3;过滤;
(4)滤液D中溶质为Na AlO2,偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaAlO2; AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)氢氧化铝不溶于碳酸溶液但能溶于稀盐酸,生成氯化铝,所以不能用稀盐酸代替二氧化碳,
故答案为:不能;因为过量的盐酸与Al(OH)3反应生成AlCl3(或者AlO2-+4H+═Al3++2H2O).
点评 本题考查物质分离提纯,为高频考点,涉及离子方程式的书写、物质分离提纯等知识点,明确化学反应原理、物质性质差异性是解本题关键,注意:氢氧化铝能溶于强酸强碱溶液但不溶于弱酸弱碱溶液,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
?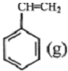 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
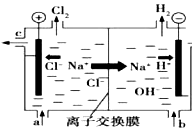 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

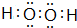 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl是电解质,故NaCl晶体能导电 | |
| B. | 浓溶液的导电能力一定强 | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 熔融状态下 NaHSO4的电离方程式为:NaHSO4=Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 | |
| B. | 中和热△H=-57.3 kJ•mol-1,所以1.00 L 1.00 mol•L-1 H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量 | |
| C. | 用等体积的0.50 mol•L-1盐酸、0.55 mol•L-1 NaOH溶液进行中和热测定的实验,会使测得的值偏大 | |
| D. | 在101 kPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com