
| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
分析 A.减小容器体积,压强增大,平衡向气体体积减小的方向进行;
B.化学反应中,两种反应物,增大一种物质的量会提高另一种物质转化率,本身转化率减小;
C.反应是放热反应,降温平衡向放热反应方向进行,反应速率减小,正逆反应速率都减小;
D.反应速率之比等于化学方程式计量数之比,为正反应速率之比,达到平衡状态需要满足正逆反应速率相同;
解答 解:A.反应A(g)+B(g)?2C(g),反应前后是气体体积不变的反应,其他条件不变,减小容器体积,氨气增大平衡不移动,故A正确;
B.其他条件不变,增大c(A),B的转化率增大,A的转化率减小,故B错误;
C.降低温度,化学反应速率减小,正逆反应速率都增大,v正增大,v逆增大,故C错误;
D.化学反应速率之比等于化学方程式计量数之比为正反应速率之比,2v正(A)═v正(C),只有当达到平衡时2v正(A)═v逆(C),C的正逆反应速率相同,说明反应达到平衡状态,v正(A)═2v逆(C),速率之比错误,故D错误;
故选A.
点评 本题考查学生影响化学反应速率和化学平衡移动的因素知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
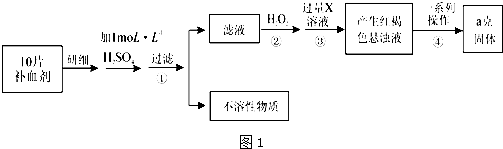
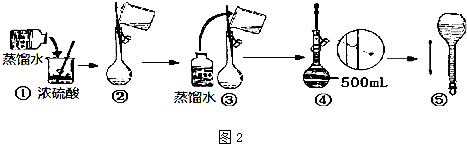
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温有利于提高反应的转化率 | |
| B. | 高温可增大反应的限度 | |
| C. | 700K时反应催化剂活性最强,反应速率更快 | |
| D. | 高温才可以自发向右进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
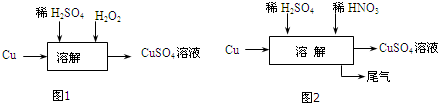
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com