
| �¶�/�� | 400 | 500 | 800 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
���� ��1����֪��C��ʯī��+$\frac{1}{2}$O2��g���TCO��g����H1=-111kJ/mol
��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H2=-242kJ/mol
��C��ʯī��+O2��g���TCO2��g����H3=-394kJ/mol
�ɸ�˹���ɣ���-��-�ٵã�CO��g��+H2O��g���TCO2��g��+H2��g������H=��H3-��H2-��H1���㣻
��2��A��CO��g��+H2O��g���TCO2��g��+H2��g���ǵ�����ķ�Ӧ��������ѹǿʼ�ղ��䣻
B���ﵽ��ѧƽ��״̬ʱ�������ʵ�Ũ�ȱ��ֲ��䣻
C��v����H2��=v����H2O�������ߵĻ�ѧ��������ͬ������v����H2��=v����H2����
D��c��CO2��=c��CO���������ܱ�֤����Ũ�ȱ��ֺ㶨��
��3��10min��ﵽƽ��ʱCO2��ƽ��Ũ��Ϊxmol/L���������η���ʾ�������Ũ�ȵı仯��Ȼ�����ƽ�ⳣ������ʽ��v=$\frac{��c}{��t}$��ת���ʹ�ʽ���㣻
��4��A������Ӧ��Ũ�ȣ���ѧ��Ӧ��������ƽ�������ƶ���B�������¶ȣ���ѧ��Ӧ���ʼӿ죬�÷�Ӧ�Ƿ��ȷ�Ӧ����ѧƽ�������ƶ���
C��������������ȥ����ѧ��Ӧ���ʼ�С��ƽ�������ƶ���
D�������Ի�ѧƽ�ⲻ����Ӱ�죮
��� �⣺��1����֪��25��ʱ��
��C��ʯī��+$\frac{1}{2}$O2��g���TCO��g����H1=-111kJ/mol
��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H2=-242kJ/mol
��C��ʯī��+O2��g���TCO2��g����H3=-394kJ/mol
�ɸ�˹���ɣ���-��-�ٵã�CO��g��+H2O��g���TCO2��g��+H2��g�����ʡ�H=��H3-��H2-��H1=-394kJ/mol-��-242kJ/mol��-��-111kJ/mol��=-41kJ/mol��
�ʴ�Ϊ��CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol��
��2��A��CO��g��+H2O��g���TCO2��g��+H2��g���ǵ�����ķ�Ӧ��������ѹǿʼ�ղ��䣬��A����
B���ﵽ��ѧƽ��״̬ʱ�������ʵ�Ũ�ȱ��ֲ��䣬���������c��CO�����䣬˵���ﵽ�˻�ѧƽ��״̬����B��ȷ��
C��v����H2��=v����H2O�������ߵĻ�ѧ��������ͬ������v����H2��=v����H2����˵���ﵽ�˻�ѧƽ��״̬����C��ȷ��
D��c��CO2��=c��CO���������ܱ�֤����Ũ�ȱ��ֺ㶨����˲���ȷ���ﵽ�˻�ѧƽ��״̬����D����
�ʴ�Ϊ��BC��
��3����800��ʱ��2L���ܱ������м���4molCO��g����6molH2O��g����c��CO��=$\frac{4mol}{2L}$=2mol/L��c��H2O��=$\frac{6mol}{2L}$=3mol/L��
10min��ﵽƽ��ʱCO2��ƽ��Ũ��Ϊxmol/L����
CO��g��+H2O��g���TCO2��g��+H2��g��
��ʼŨ�ȣ�2 3 0 0
ת��Ũ�ȣ�x x x x
ƽ��Ũ�ȣ�2-x 3-x x x
K=$\frac{{x}^{2}}{��2-x������3-x��}$=1�����x=1.2��
v��H2��=$\frac{1.2mol/L}{10min}$=0.12mol/��L•min����
CO��ת������$\frac{1.2mol/L}{2mol/L}$��100%=60%��
�ʴ�Ϊ��1.2mol/L��0.12mol/��L•min����60%��
��4��A������CO��Ũ�ȣ���ѧ��Ӧ��������ƽ�������ƶ�����A��ȷ��B�������¶ȣ���ѧ��Ӧ���ʼӿ죬�÷�Ӧ�Ƿ��ȷ�Ӧ����ѧƽ�������ƶ�����B����
C��������������ȥ���������������Ũ�ȣ���ѧ��Ӧ���ʼ�С��ƽ�������ƶ�����C����
D��ʹ�ø�Ч��������ѧ��Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����D����
�ʴ�ΪA��
���� ���⿼�����Ȼ�ѧ����ʽ�ļ��㡢��ѧ��Ӧ���ʵļ��㡢��ѧƽ���ƶ��ͻ�ѧƽ�ⳣ���ļ��㣬Ϊ�߿���Ƶ���㣬�Ѷ��еȣ�ע���˹���ɺ����η��ĺ���Ӧ�ã�


 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 20 g D2O�����ĵ�����Ϊ10 NA | |
| B�� | 25��ʱ��pH=13��Ba��OH��2��Һ�к��е�OH-��ĿΪ0.1 NA | |
| C�� | 1 mo1 Na��������Na2O2��ʧȥ������ĿΪ2 NA | |
| D�� | ������������Ӧ���ɱ�״����22.4 L�Ȼ��⣬���ѻ�ѧ������Ϊ2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
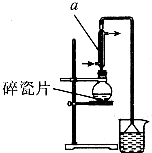 ������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�
������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=12����Һ��NO3-��I-��Na+��Al3+ | |
| B�� | 0.1mol•L-1 CH3COONa��Һ��Mg2+��H+��Cl-��SO42+ | |
| C�� | Kw/c��H+��=0.1mol•L-1 ����Һ��Na+��K+��SiO32-��NO3- | |
| D�� | 0.1mol•L-1 KMnO4��Һ��Na+��Mg2+��NO3-��SO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������£�SO2����100%��ת��ΪSO3 | |
| B�� | ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ��������Ч�� | |
| C�� | �ﵽƽ��ʱ��SO2��SO3��Ũ�ȱ��ֲ��� | |
| D�� | Ϊ�����SO2��ת���ʣ������ʵ����O2��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
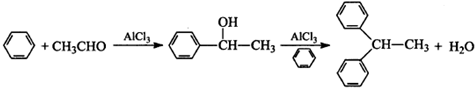
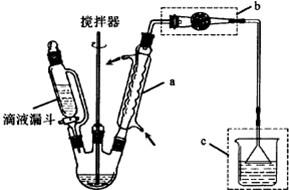
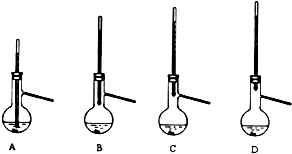
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | NaCl | NaHCO3 | NH4Cl |
| 40��ʱ�ܽ��/g | 37 | 13 | 46 |
| 10��ʱ�ܽ��/g | 33 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
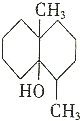 ����ս���ʱ����ˮ��̼������ͷų�һ�ֳ�Ϊ�����صĻ�ѧ���ʣ���ṹ��ʽ��ͼ��ʾ�������Լ����ɼ��ȣ����������ط�Ӧ���ǣ�������
����ս���ʱ����ˮ��̼������ͷų�һ�ֳ�Ϊ�����صĻ�ѧ���ʣ���ṹ��ʽ��ͼ��ʾ�������Լ����ɼ��ȣ����������ط�Ӧ���ǣ�������| A�� | ������ | B�� | �����Ũ����Ļ����Һ | ||
| C�� | ���Ը��������Һ | D�� | ̼������Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com