
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中滴加NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A、溶度积常数大的物质能转化为溶度积常数小的物质;
B、Al与浓硝酸发生钝化现象;
C、Ag+与NH3•H2O先生成AgOH沉淀,当氨水过量时生成银氨溶液;
D、高温下,铁和水蒸气发生氧化还原反应生成黑色的四氧化三铁.
解答 解:A、溶度积常数大的物质能转化为溶度积常数小的物质,向AgCl悬浊液中滴加KI溶液,白色沉淀转化为黄色,说明AI的溶度积小于AgCl,二者结构相似,溶度积越大其溶解度越大,所以AgI的溶解度小于AgCl,故A正确;
B、Al与浓硝酸发生钝化现象,钝化是化学变化,故B错误;
C、Ag+与NH3•H2O先生成AgOH沉淀,当氨水过量时生成银氨溶液,溶液变澄清,所以Ag+与NH3•H2O不能大量共存,故C错误;
D、高温下,铁和水蒸气发生氧化还原反应生成黑色的四氧化三铁,氧化铁呈红棕色,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高考高频点,侧重考查元素化合物知识、物质之间的反应及其现象,易错选项是C,注意银离子和氨水能生成银氨溶液.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 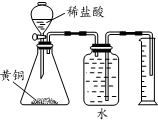 测定黄铜(Cu、Zn合金)中Zn 的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝片加入浓硫酸中,探究Al的活泼性 | |
| B. | 将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al (OH)3沉淀的生成及溶解 | |
| C. | 将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Al(OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)═2NO2(g)△H,随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)═2NO2(g)△H,随温度升高,混合气体的颜色变深.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com