
 下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| B | 晶红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红后不褪色 | SO2有酸性,没有漂白性 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
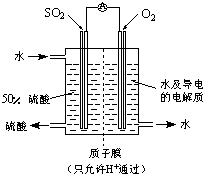
查看答案和解析>>
科目:高中化学 来源: 题型:
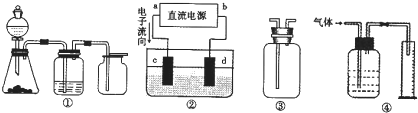
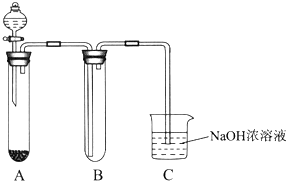 某课外小组同学用下图所示装置进行实验(夹持装置已省略).
某课外小组同学用下图所示装置进行实验(夹持装置已省略).查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省高三12月月考化学试卷(解析版) 题型:填空题
氧化镁可用于治疗胃酸过多,以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)该流程中进行了两次过滤操作,该操作所需的玻璃仪器有 。
(2)加入H2O2氧化时,发生反应的离子方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C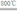 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C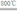 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C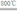 MgO+S↑+3CO↑
MgO+S↑+3CO↑
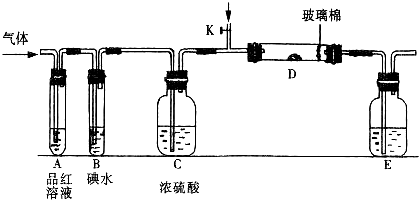
利用下图装置对煅烧产生的气体进行分步吸收或收集

①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a NaOH 溶液 b Na2CO3溶液 c 稀硝酸 d 酸性KMnO4溶液
查看答案和解析>>
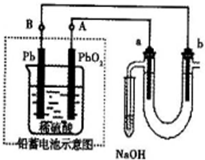
科目:高中化学 来源:山东省模拟题 题型:实验题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com