
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
【答案】D
【解析】
在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物。
A. 液态氯化氢和固体氯化钠不含自由移动的离子,所以不导电,但氯化氢和氯化钠在水溶液里能电离出自由移动的离子而使溶液导电,所以氯化氢和氯化钠是电解质,故A错误;
B.![]() 的水溶液均导电是因为氨气、二氧化碳分别和水反应生成的氨水、碳酸电离出自由移动的离子而使其溶液导电,电离出的自由移动的离子不是氨气和二氧化碳电离的,所以
的水溶液均导电是因为氨气、二氧化碳分别和水反应生成的氨水、碳酸电离出自由移动的离子而使其溶液导电,电离出的自由移动的离子不是氨气和二氧化碳电离的,所以![]() 都不是电解质,是非电解质,故B错误;
都不是电解质,是非电解质,故B错误;
C. 铜、石墨是单质,不是电解质,也不是非电解质,故C错误;
D. 酒精和蔗糖在水溶液里和熔融状态下均以分子存在,导致它们的水溶液或熔融态都不导电,所以它们是非电解质,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给三位开发锂离子电池的科学家。锂离子电池正极材料是决定其性能的关键.
(1)锰酸锂(LiMn2O4)电池具有原料成本低、合成工艺简单等优点。Li+能量最低的激发态离子的电子排布图为________,该晶体结构中含有Mn4+,基态Mn4+核外价层电子占据的轨道数为__________________个。
(2)磷酸铁锂(LiFePO4)电池安全、充电快、使用寿命长,其中P原子的杂化方式为__________________,阴离子的空间结构为__________________。
(3)三元正极材料![]() 掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
(4)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。

①晶胞可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处。晶体的化学式为__________________,图中铋原子坐标参数:A为(0,0,0), B为(0,1,1),C为__________________。
②若晶胞参数为anm,则铋原子的半径为__________________nm,八面体间隙中的锂原子与四面体间隙中的锂原子之间的最短距离为__________________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
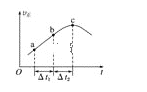
A. 反应物的总能量低于生成物的总能量
B. Δt1=Δt2时,CO的转化率:a~b段小于bc段
C. 反应在c点达到平衡状态
D. 反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。
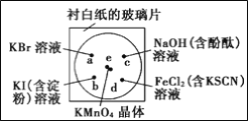
(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用碱性溶液吸收多余的氯气,防止污染环境。若某一次兴趣小组实验中将多余的氯气用100 mL 2.00 mol·L-1的NaOH溶液恰好完全吸收。分析吸收液测得ClO-和![]() 的物质的量浓度之比为5∶1。请回答:
的物质的量浓度之比为5∶1。请回答:
(1)吸收的氯气的物质的量为____mol。
(2)若不考虑吸收前后溶液体积变化,则吸收液中Cl-的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期主族元素。由X、Y、Z、W四种元素中的几种元素形成的化合物与W、Z的单质之间的转化关系如图所示(部分产物未给出),其中Z为金属单质且与X位于不同主族,下列说法正确的是( )

A.Y和W形成的化合物YW4易溶于水
B.Y6X6燃烧时火焰明亮,且无黑烟产生
C.W的氧化物对应的水化物的酸性一定比Y的强
D.Z与W形成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
(1)实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要___________、___________。
为了减少实验误差:实验过程中将NaOH溶液________(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的________,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式_________________________________。
(2)通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=________kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+![]() O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为__________kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=_______kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com