
分析 (1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,加热会促进胶体聚沉;
(2)氯化铁水解生成氢氧化铁胶体;
(3)胶体的特有的性质为丁达尔效应;
(4)胶体遇电解质溶液能发生聚沉得到氢氧化铁沉淀,继续滴加硫酸,氢氧化铁沉淀溶解.
解答 解:(1)甲同学向1mol•L-氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,故答案为:丙;
(2)氯化铁水解生成氢氧化铁胶体,化学方程式:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;
(3)丁达尔效应是胶体的特有性质,可用来鉴别胶体,当用激光笔照射时,会有一道明亮的光路,
故答案为:用激光笔照射,若有一条光亮的通路,则有胶体生成;丁达尔效应;
(4)向氢氧化铁胶体中胶粒带正电,当逐滴加饱和的硫酸铵溶液后,会发生胶体的聚沉;当入过量H2SO4溶液,H2SO4电离出的SO42-使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解,会观察到先出现红褐色沉淀,后沉淀消失.
故答案为:氢氧化铁胶粒带正电,遇硫酸铵溶液发生胶体的聚沉;先生成红褐色的沉淀,后溶解为黄色溶液.
点评 本题考查胶体的制备、性质,题目难度不大,易错点为胶体的制备,注意制备方法,本题重点把握胶体的聚沉的性质.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对燃烧煤时产生的尾气进行除硫处理 | |
| B. | 往已经酸化的土壤撒石灰中和 | |
| C. | 煤燃烧时鼓入足量空气 | |
| D. | 将煤除硫后再燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

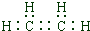 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com