
| m |
| M |
| 10 |
| 12 |
| m |
| M |
| m |
| M |
| 1.2g |
| 0.01mol |


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 苯 | 溴单质 | 加亚硫酸钠溶液洗涤,分液 |
| B | 淀粉 | 葡萄糖 | 水,过滤 |
| C | 甲烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 乙酸乙酯 | 乙酸 | 加入氢氧化钠溶液,分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①②④⑤ |
| C、②④⑤⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
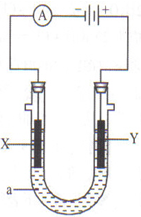 电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 | B、13 | C、14 | D、15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2溶于水生成碳酸,SiO2不溶于水也不能跟水直接反应生成硅酸 | ||||
B、在高温条件下,SiO2和Na2CO3能发生反应:SiO2+Na2CO3
| ||||
| C、SiO2熔点比CO2高 | ||||
| D、CO2通入Na2SiO3稀溶液中,生成的H2SiO3逐渐聚合而形成硅酸溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO?4SiO2?H2O |
| B、次氯酸钠、石灰、明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品 |
| C、水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体 |
| D、毛、发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40gNaOH溶于1L水中所得溶液的物质的量浓度为1mol/L |
| B、不互溶的液态混合物可用分液的方法分离 |
| C、用砂纸打磨掉铝表面的氧化膜,在空气中点燃可像镁一样剧烈燃烧 |
| D、物质所含元素化合升高,一定是被另一种物质把它氧化了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com