常见元素A、B、C、D,其原子结构的相关信息如下表:
| 元素 | 相关信息 |
| A | 核外电子总数等于该基态原子电子层数 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 基态原子L电子层中有3个未成对电子 |
| D | 生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质 |
| E | 外围电子排布为(n+1)d3n(n+2)sn |
请回答下列问题:
(1)按电子排布,可把周期表里的元素划分成5个区,E元素属
区;B原子基态原子的价电子排布图为
(2)ABC分子的空间构型
; C
2A
4分子中,C原子杂化方式
.
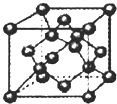
(3)如图所示,为B单质晶体的一种晶胞,密度为d g?cm
-3,阿伏伽德罗常数的值为N
A,则该晶胞的边长为
cm.(用含d和N
A式子表示)
(4)已知C
2A
4和过氧化氢混合可作火箭推进剂.液态C
2A
4与足量液态过氧化氢反应生成C的单质和气态水,转移1.6mol电子时放出256.0kJ的热量.已知:H
2O(l)=H
2O(g)△H=+44.0kJ﹒mol
-1 写出液态C
2A
4和足量液态过氧化氢反应生成C的单质和液态水的热化学方程式:
(5)标准状况下,C的某种氧化物(原子个数比为1:1)40L与15L氧气混合通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,请写出该反应的离子方程式
(6)D的单质与E的红色氧化物在高温条件下反应的方程式为
.

 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表: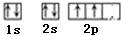 ,故答案为:ds;
,故答案为:ds; ;
;

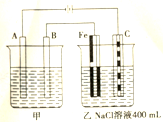 下图为相互串联的甲乙两个电解池,试回答:
下图为相互串联的甲乙两个电解池,试回答: