
| A. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| B. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| C. | 理想的催化剂可以大幅度提高目标产物在最终产物的比率 | |
| D. | Na与H2O的反应是熵减的放热反应,该反应能自发进行 |
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol | B. | 0.03mol | C. | 0.05mol | D. | 0.17mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
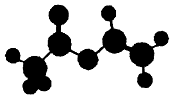 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
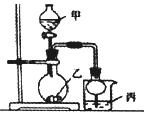
| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红红褪色 |
| B | 浓盐酸 | KMnO4 | 淀粉-Kl溶液 | 溶液变蓝 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
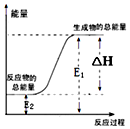
| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
| t1 | t2 | |||
| 1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
| 2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |
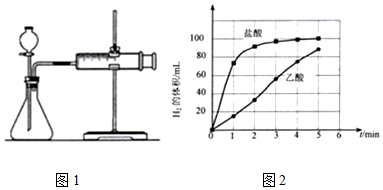
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂 | |
| B. | 生石灰用于食品抗氧化剂 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com