
| A. | ①②④③ | B. | ④①②③ | C. | ③②①②④ | D. | ④③②① |
分析 检验氯离子选择硝酸银溶液,检验HCO3-用HNO3溶液,检验碳酸根离子选择硝酸钡溶液,用三种试剂将三种离子检验出来,每加一种试剂能够检验出一种离子,此时要注意每加入一种试剂只能与一种离子结合,来选择加入试剂顺序及操作步骤.
解答 解:Cl-用含有AgNO3溶液检验,二者反应生成白色沉淀AgCl;
CO32-用Ba(NO3)2溶液检验,二者反应生成白色沉淀BaCO3;
HCO3-用HNO3溶液检验,二者反应生成气体;HCO3-和硝酸钙不反应;
Cl-、CO32-、HCO3-都和AgNO3反应,只有CO32-和Ba(NO3)2溶液反应生成白色沉淀,为了防止干扰,应该先检验CO32-、再检验HCO3-;
故选A.
点评 本题考查了常见离子的检验,完成此题,可以依据已有的知识进行,同时需考虑物质之间的反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
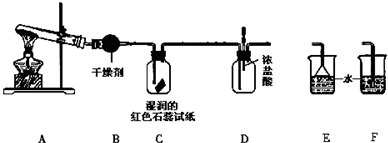
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
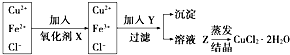
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 被提纯的物质[括号内物质是杂质] | 除杂试剂 | 反应的离子方程式 | |
| 1 | NaHCO3溶液( Na2CO3) | ||
| 2 | NaCl溶液 (MgCl2) | ||
| 3 | KNO3溶液(KCl) | ||
| 4 | Cu(Mg) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有的分子数NA | |
| B. | 常温常压下,4.4gCO2的物质的量一定为0.1mol | |
| C. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
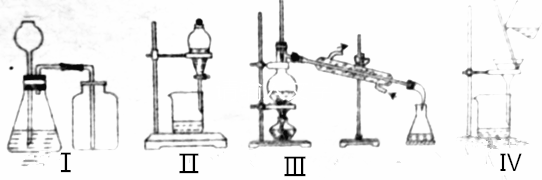
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com