
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
分析 (1)②铝为金属单质,和酸反应生成盐和水的氧化物为碱性氧化物,含硝酸跟离子的盐为硝酸盐,非电解质是水溶液中和熔融状态下都不导电的化合物为非电解质;
(2)(NH4)2SO4在水溶液中完全电离生成铵根离子和硫酸根离子.
解答 解:(1)②铝是金属单质,③Na2O 是碱性氧化物,属于硝酸盐的是⑥KNO3 ,非电解质是④SO2,
故答案为:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质 | ② | ③ | ⑥ | ④ |
点评 本题考查了物质分类、物质组成、物质性质等,注意知识的积累,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L丁烷中C-C键数目为0.4NA | |
| B. | 0.1mol葡萄糖分子中官能团数目为0.6NA | |
| C. | 28g N2和NO组成的混合物中分子数目可能为0.9NA | |
| D. | 1L pH=13的NaOH溶液中,Na+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L氧气所含的原子数为NA | |
| B. | 2.3g金属钠变为钠离子得到0.1NA电子 | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
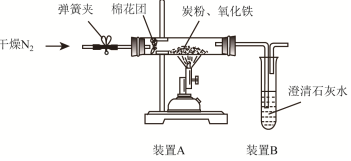
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

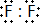 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).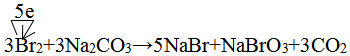 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com