
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________,此法的最大缺点是__________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________;向混合溶液中通入热空气的反应的离子方程式是___________________;由滤液得到无水硫酸铜的实验操作是______________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
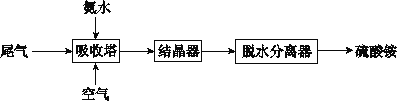
①吸收塔中发生反应的化学方程式是_______________________。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 产生有污染的气体 Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+(或Fe2O3+Cu+6H+=3H2O+2Fe2++Cu2+) 4Fe2++4H++O2=4Fe2++2H2O 加热、蒸发 4NH3H2O+2SO2+O2=2(NH4)2SO4+2H2O 调节氨水的流量
CuSO4+SO2↑+2H2O 产生有污染的气体 Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+(或Fe2O3+Cu+6H+=3H2O+2Fe2++Cu2+) 4Fe2++4H++O2=4Fe2++2H2O 加热、蒸发 4NH3H2O+2SO2+O2=2(NH4)2SO4+2H2O 调节氨水的流量
【解析】
(1)① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,此法的最大缺点是产生有污染的SO2气体。
CuSO4+SO2↑+2H2O,此法的最大缺点是产生有污染的SO2气体。
②稀硫酸、氧化铁反应生成硫酸铁,硫酸铁与铜反应生成硫酸亚铁、硫酸铁,所以化学方程式是Fe2O3+Cu+6H+==3H2O+2Fe2++Cu2+;向混合溶液中通入热空气亚铁离子被氧化为铁离子,反应的离子方程式是4Fe2++4H++O2=4Fe2++2H2O;;加热蒸发滤液可得到无水硫酸铜。(2)①吸收塔中亚硫酸铵被氧化为硫酸铵,发生反应的化学方程式是4NH3H2O+2SO2+O2==2(NH4)2SO4+2H2O;
②当控制一定流量的尾气时,调节氨水的流量可调节溶液的pH。


科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.

(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为_______,该物质的分子式是_______.
(3)根据有机化合物的成键特点,预测A的可能结构并写出结构简式__________.
II.结构式的确定:

(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.经测定,有机物A的核磁共振氢谱示意图如图②,则A的结构简式为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以磷精矿[主要成分是Ca3(PO4)2,还含有少量Fe2O3、CaF2等杂质]为原料,生产磷酸二氢钾的流程如图:
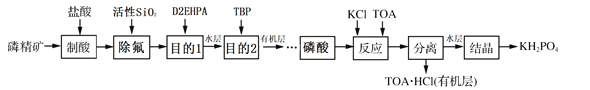
已知:①TBP、D2EHPA、TOA都是难溶于水的液态有机物,对萃取特定物质有较强的选择性,常用作萃取剂。
②萃取剂TBP对H3PO4和Fe3+有较强的萃取作用,但对Ca2+有一定的萃取作用。
③萃取剂D2EHPA仅对Fe3+有较强的萃取作用。
回答下列问题:
(1)“制酸”过程中生成磷酸的化学方程式为______。
(2)“除氟”时发生反应的化学方程式为______。
(3)“目的1”是______。
(4)“目的2”分离出的有机层中除H3PO4外,还有少量某金属阳离子。去除有机层中该阳离子的方法是用含H2SO4的磷酸洗涤,反应的离子方程式为______。
(5)“反应”时先在磷酸中加入KCl,再加入TOA,TOA的作用是______。
(6)“反应”中,TOA的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ(含磷元素微粒占全部含磷粒子的物质的量分数)随pH的变化如图所示。
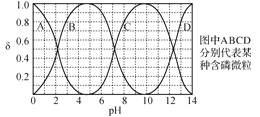
“反应”中,当pH=______(填选“2.2”、“4.5”、“9.5”或“12.4”)时,停止加入TOA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为_______。
Ⅱ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
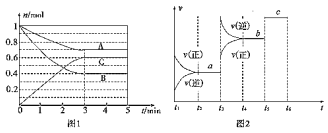
(1)该反应的化学方程式为___________________ 。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是____________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示,则K1、K2、K3之间的大小关系为___________。
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4mo1A和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是20%
C. 增加C的量,B的平衡转化率不变
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com