
| 112(b-c) |
| 160 |
| 112(b-c) |
| 120a |
| 7(c-b) |
| 10a |
| 7(c-b) |
| 10a |


科目:高中化学 来源: 题型:
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、1 mol Na完全转化为Na2O2时,失去的电子数目为2NA |
| C、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
| D、2L1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
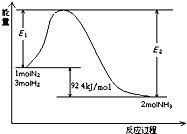
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
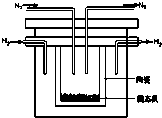
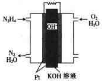 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25% |
| B、20.75% |
| C、17.85% |
| D、26.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点MgO>NaCl>KCl |
| B、含有金属阳离子的晶体一定是离子晶体 |
| C、同主族元素形成的氧化物的晶体类型均相同 |
| D、沸点:H2O>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
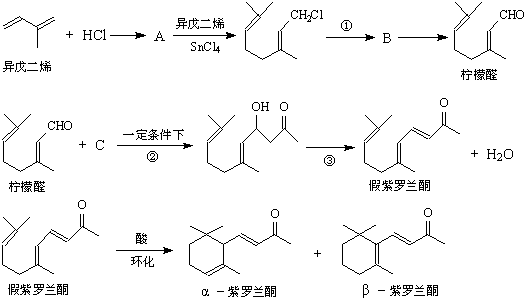
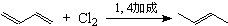
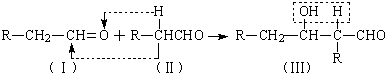
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com