
分析 (1)实验室用碳化钙和水反应制取乙炔,因为碳化钙中含有杂质而生成硫化氢等含有难闻的气体,硫化氢能和硫酸铜溶液反应生成黑色CuS沉淀;
(2)乙炔和氨基钠反应生成CHCNa,CHCNa和HCl发生加成反应生成H2CCHCl,H2CCHCl和CHCNa反应生成CHCCHCH2,CHCCHCH2和氯气发生加成反应生成CHClClCClClCHClCH2Cl,据此分析解答.
解答 解:(1)实验室用碳化钙和水反应制取乙炔,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;
因为碳化钙中含有杂质而生成硫化氢等含有难闻的气体,蓝色溶液中含有铜离子,硫化氢能和铜离子反应生成黑色CuS沉淀,离子反应方程式为Cu2++H2S═CuS↓+2H+,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;Cu2++H2S═CuS↓+2H+;
(2)炔烃具有一定的酸性,可以与活泼金属,如钠或氨基钠反应,生成炔负离子,反应方程式为CHCH+NaNH2→CHCNa+NH3,炔负离子可以与卤代烃发生如下反应:R′C≡CNa+R-X→R′C≡CR+NaX,
乙炔和氨基钠反应生成CHCNa,CHCNa和HCl发生加成反应生成H2CCHCl,H2CCHCl和CHCNa反应生成CHCCHCH2,CHCCHCH2和氯气发生加成反应生成CHClClCClClCHClCH2Cl,从而将乙炔制取1,1,2,2,3,4-六氯丁烷,涉及的反应方程式分别为:HCCH+NaNH2→CHCNa+NH3、HCCH+HCl→H2CCHCl、HCCNa+H2CCHCl→CHCCHCH2+NaCl、CHCCHCH2+3Cl2→CHClClCClClCHClCH2Cl,
故答案为:HCCH+NaNH2→CHCNa+NH3、HCCH+HCl→H2CCHCl、HCCNa+H2CCHCl→CHCCHCH2+NaCl、CHCCHCH2+3Cl2→CHClClCClClCHClCH2Cl.
点评 本题考查有机物合成,为高频考点,侧重考查学生获取信息、知识迁移能力,难点是有机合成路线设计,熟练掌握有机物结构和性质关系是解有机合成题的关键,题目难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | abc | B. | ade | C. | dce | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 三种途径所消耗的铜的物质的量相等 | |
| B. | 三种途径所消耗的硝酸的物质的量相等 | |
| C. | 所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) | |
| D. | 所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:| 化合物 名称 | 密度(g/mL ) | 熔 点(℃) | 沸 点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.| 温 度 | 250℃ | 300℃ | 350℃ |
| Κ | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 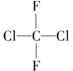 和 和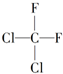 是两种不同的物质 是两种不同的物质 | |
| B. | 聚氯乙烯的单体为CH2═CHCl | |
| C. | 乙烷和乙烯均能使酸性KMnO4溶液褪色 | |
| D. | 1 mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com