
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
①Cu2O+2H+===Cu+Cu2++H2O;
②部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为__________________。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是________。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是__________;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是__________________。
(4)Ⅳ中加NaClO的目的是______________。
(5)由上述实验可以获得结论:原样品所有可能的成分组合为____________;________________。(用化学式表示、任写两种即可)
答案 (1)2Al+2OH-+2H2O===2AlO +3H2↑
+3H2↑
(2)SiO2 (3)Fe2+ 向酸性KMnO4溶液中滴加待测液,酸性KMnO4溶液褪色(或向待测液中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀)
(4)将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀。
(5)组合1:Al、Fe2O3、Cu2O 组合2:Al、Cu2O、Fe3O4 组合3:Al、Fe2O3、Cu2O、Fe3O4
解析 Ⅰ.能与NaOH反应产生气体的只有Al。Ⅱ.加入稀硫酸产生白色沉淀,且能完全溶解,白色沉淀是Al(OH)3,不含H2SiO3,说明原混合物中一定没有SiO2。Ⅳ、Ⅴ中的现象说明Ⅲ所得溶液C中含有Cu2+,原物质中一定有Cu2O,但Cu2O与稀硫酸反应有固体铜生成,要使溶液中的固体完全溶解,必然还会有产生Fe3+的物质,因而Fe2O3和Fe3O4至少有一种。溶液C中除含H+、Cu2+、Fe2+外还可能含有Fe3+,因而检验Fe2+要用酸性KMnO4溶液。注意:此处不能选KSCN和氯水。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g)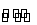 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
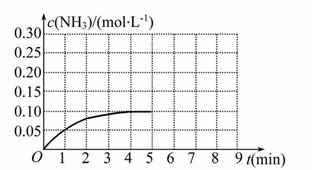
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
 (1)NH4Al(SO4)2可作净水剂,其原理是___________________________
(1)NH4Al(SO4)2可作净水剂,其原理是___________________________
_
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中c(NH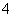 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH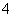 )。
)。
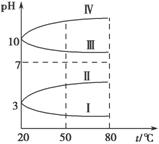
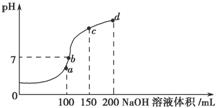
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填字母),导致pH随温度变化的原因是 ;
 ②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO )-c(NH
)-c(NH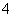 )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是________点,在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
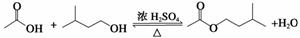
| 相对分 子质量 | 密度/ (g·cm-3) | 沸点/℃ | 水中 溶解性 | |
| 异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
| 乙酸 | 60 | 1.049 2 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
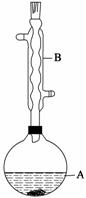
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是__________________________________,
第二次水洗的主要目的是__________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________。
(5)实验中加入少量无水MgSO4的目的是_______________________________________。
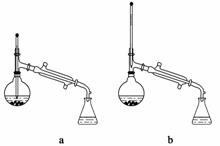
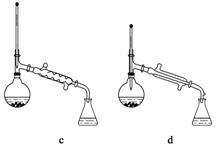
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
(7)本实验的产率是________(填标号)。
a.30% b.40%
c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏____(填“高”或“低”) ,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组对铝表面氧化膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(如空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期盛放或腌制咸菜。该小组同学设计了一个实验以探究其中的原因。他们的实验过程如下所示:
| 实验 | ||
| 编号 | 实验过程 | 实验现象 |
| 1 | 取一小片铝片于试管中,加入2 mL 1.0 mol·L-1盐酸 | 30 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 2 | 取一小片铝片于试管中,加入2 mL 0.5 mol·L-1硫酸 | 55 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 3 | 取一小片铝片于试管中,加入氯化铜稀溶液 | 3 min左右表面产生少量气泡,且铝表面析出一些红色固体 |
| 4 | 取一小片铝片于试管中,加入硫酸铜稀溶液 | 一直没有明显的变化 |
(1)你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是__________________________________。
(2)根据该实验现象,你认为铝制容器不能长期盛放或腌制咸菜的原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中一定能大量共存的离子组是( )
A.使pH试纸呈红色的溶液:Na+、Al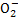 、S
、S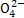 、Cl-
、Cl-
B.澄清透明溶液:Cr2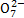 、S
、S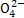 、K+、N
、K+、N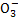
C.pH=0的溶液:Na+、C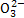 、Fe3+、N
、Fe3+、N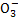
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:HC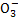 、N
、N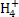 、Cl-、Ca2+
、Cl-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
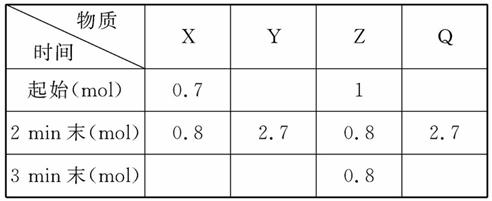
在2 L密闭容器中进行反应:
mX(g)+nY(g)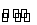 pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
已知2 min内v(Q)=0.075 mol·L-1·min-1,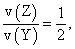
(1)试确定以下物质的相关量:
起始时n(Y)=__________,n(Q)=________。
(2)方程式中m=__________,n=_________,
p=____________,q=___________。
(3)用Z表示2 min内的反应速率_________。
(4)2 min末Q的转化率为____________。
(5)试判断在2 min内v(正)________v(逆)(填“>”“<”或“=”),在2 min末~3 min末v(正)_________v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( )
A.K+、Na+、Cl-、NO
B.K+、Na+、Br-、SiO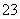
C.H+、Fe2+、SO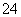 、Cl2
、Cl2
D.K+、Ag+、NH3·H2O、NO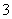
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com