
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.50mol/L | D. | 0.20mol/L |
科目:高中化学 来源: 题型:选择题
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液一定显蓝色 | |
| C. | 若能观察都蓝色出现,刚起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 升高温度,①、②的反应速率均加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=2mol/(L•min) v(B)=2mol/(L•min) | |
| B. | v(A)=2mol/(L•min) v(C)=2mol/(L•min) | |
| C. | v(A)=1mol/(L•min) v(B)=2mol/(L•min) | |
| D. | v(A)=1mol/(L•min) v(C)=1.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na、Mg分别与冷水反应来证明Na、Mg的金属性强弱 | |
| B. | 用同物质的量浓度的H2SO3酸性比H2CO3强,证明S的非金属性比C强 | |
| C. | 用HCl和HBr形成的难易程度,证明Cl的非金属性比Br强 | |
| D. | 用Cu、Mg分别与盐酸反应来证明Cu、Mg的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
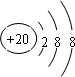 .
. ,C的最高价氧化物的水化物化学式为:Al(OH)3.
,C的最高价氧化物的水化物化学式为:Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400 mL | B. | 200 mL | C. | 150 mL | D. | 80 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂是较轻的金属 | B. | LiOH的碱性比NaOH弱 | ||
| C. | 锂的化学性质比钠活泼 | D. | 锂在空气中燃烧生成Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
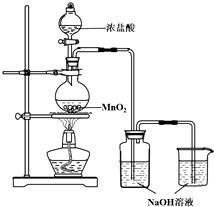 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
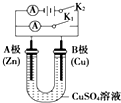 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com