
| A. | 磺化反应 | B. | 消去反应 | C. | 水解反应 | D. | 聚合反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等 | |
| B. | 50ml18.4 mol/L浓硫酸与足量铜加热反应,生成S02分子的数目为0.4 6 NA | |
| C. | 0.1mol/LMgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | Br- | C. | I- | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O所含电子数为10NA | |
| B. | 1mol Al与足量的稀盐酸溶液反应生成氢气1.5mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2L | |
| D. | 在非标准状况下,22.4L O2含有的分子数一定不是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:5 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
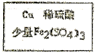 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O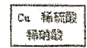 $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O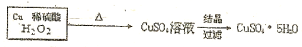 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | 动植物生长不可缺少的元素,是组成蛋白质的重要元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com