
ʵ������ȡSO2�ķ�Ӧԭ��Ϊ��
����Na2SO3��H2SO4��Ũ��===Na2SO4��SO2����H2O����������װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�
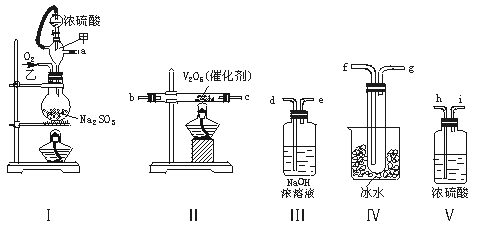
������1����Щװ�õ�����˳���������ҵķ�����_____________��_____________��_____________��_____________��
����_____________��_____________��_____________��_____________������ӿڵı�ţ���
������2��ʵ��ʱ��������������ԭ����_____________��
������3�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ����Ũ��������ȴ������Ⱥ�˳����_____________��
������4�������۲쵽��������_____________��
������5���ڢ��ô�������ƿʱ��SO2��ת���ʻ�_____________����������䡱��С������
������6����n mol Na2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ��Ƶâ�����m g����ʵ����SO2��ת����Ϊ___________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�ݻ�Ϊ2 L���ܱ������ڼ���0.2 molA��0.6 molB����һ�������·�����Ӧ��A(s)��3B(g) 2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 64.0 | 50.7 | 42.9 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK�� ����H 0(���������)��
��2��1000 ��ʱ,4 min��ﵽƽ��.��4 min��D��ƽ����Ӧ����v(D)�� ��B��ƽ��ת����Ϊ ��ƽ��ʱB��������� ��
��3������ߢ���B��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ� ��
A������C���� B������A����
C���Ƴ�����D D�����ͷ�Ӧ�¶�
E����С�������ݻ� F��������ʵĴ���
��4������˵������˵����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A�������ڻ�������ѹǿ����ʱ��仯����
B��B�����ʲ���ʱ��ı仯���仯
C��c(B)�Uc(D)=1�U1
D�����������ܶȱ��ֲ���(M(B)��M(D))
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ӷ���ʽBa2����SO42��===BaSO4�������ܱ�ʾ(����)
�ٿ����Ա�����Һ���������������Һ֮��ķ�Ӧ��������������Һ���������������Һ֮��ķ�Ӧ����ϡ����������Ա�����Һ֮��ķ�Ӧ ������������Һ��ϡ���ᷴӦ
A���٢� B���٢ڢ�
C���ڢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�У�SO2���������Ե��ǣ� ����
A��2SO2+O2 2SO3 B��SO2+H2O
2SO3 B��SO2+H2O H2SO3
H2SO3
C��2H2S+SO2==3S��+2H2O D��SO2+2H2O+Cl2==H2SO4+2HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����δ֪��Һ���Ƿ���SO42-�����в�������������ǣ� ��
A�����������ữ�����ᱵ��Һ B���ȼ������ữ���ټ������ᱵ��Һ
C���������ữ�˵�BaCl2��Һ D���ȼ������ữ���ټ���BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ� ��
A��SO2��ʹƷ����Һ����ˮ�����ԣ�KMnO4��Һ��ɫ������ΪSO2����Ư����
B��SO2��Cl2��������Ư�����ʣ��������ʵ�������������ͬʱ�����ڳ�ʪ����ɫ����ʱ������ǿƯ��Ч��
C������̿ʹ��ɫ������ɫ��������̼���ʵĻ�ԭ�ԣ�ʹ��ɫ���ʷ����˻�ԭ��Ӧ
D��SO2ʹƷ����Һ��ɫ����ɫ�����Һ���ȣ���Һ���±�Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ��ͨ��SO2һ�����������������
A�� Ba(OH)2 B�� Ba(NO3)2 C�� Na2S D�� BaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�˵����ȷ����
A��ȷ��ȡ0.4000 g NaOH��������100 mL 0.1000 mol��L-1��NaOH����Һ
B����֪Ksp[Fe(OH)3]=4.0��10-38����Fe3++3H2O Fe(OH)3+3H+��ƽ�ⳣ��K=2.5��10-5
Fe(OH)3+3H+��ƽ�ⳣ��K=2.5��10-5
C��100 mL pH��3��HA��HB�ֱ���������п��Ӧ��HB�ų��������࣬˵��HB���Ա�HA��
D�����ڷ�Ӧ2SO2(g)+O2(g) 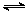 2SO3(g)��ѹ���������ʹѹǿ���������������䣩����SO2��ת��������ƽ�ⳣ��KҲ����
2SO3(g)��ѹ���������ʹѹǿ���������������䣩����SO2��ת��������ƽ�ⳣ��KҲ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com