
【题目】无机化合物可根据其组成和性质进行分类,如: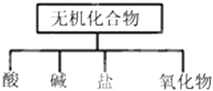
(1)如图所示的物质分类方法名称是 .
(2)以Na、K,H,O,C,S,N中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面.
物质 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)写出⑦转化为⑤的化学方程式 .
(4)实验室制备⑦检验该气体的方法是 .
【答案】
(1)树状分类法
(2)NaOH;HNO3;NaNO3
(3)Na2O+CO2═Na2CO3
(4)将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳
【解析】解:(1)交叉分类法含义:根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法含义:对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法;故答案为:树状分类法;(2)以H、O、S、N、Na五种元素中任意两种或三种元素可组成酸有:H2SO4或HNO3 , 碱有:NaOH、KOH或NH3H2O,盐有:NaNO3、Na2SO4、NH4NO3 , 氧化物有:H2O、NO、NO2、N2O5、SO2、SO3、Na2O,氢化物有:NH3 , H2O等,故答案为:②HNO3 ③NaOH、KOH或NH3H2O ⑥NaNO3、Na2SO4、NH4NO3(任写一种); (3)因CO2能与氧化钠反应生成碳酸钠:Na2O+CO2═Na2CO3;故答案为:Na2O+CO2═Na2CO3;(4)检验二氧化碳气体,把气体通入澄清的石灰水,石灰水变浑浊,说明气体为二氧化碳;故答案为:将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳.
(1)根据交叉分类法和树状分类法的定义判断;(2)以H、O、S、N、Na五种元素中任意两种或三种元素可组成酸、碱、盐、氧化物等,根据常见的物质书写;(3)根据二氧化碳可以与氧化钠反应生成碳酸钠;(4)根据CO2的检验方法:把气体通入澄清的石灰水,石灰水变浑浊,说明气体为二氧化碳.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g) △H =-566kJ/mol
2Fe(s)+![]() O2(g)=Fe2O3(s) △H =-825.5 kJ/mol
O2(g)=Fe2O3(s) △H =-825.5 kJ/mol
则,(1)反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H =____________。
2Fe(s)+3CO2(g) △H =____________。
(2)反应 ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在
Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在
一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡,则CO的平衡转化率=____________。
II.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:![]() 。请根据图示回答下列问题:
。请根据图示回答下列问题:
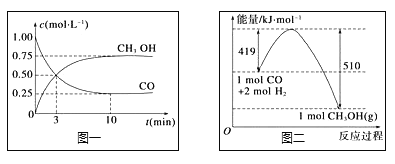
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ____________![]() △H =____________。
△H =____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
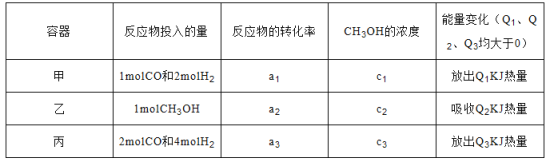
则下列关系正确的是 ____________。
A c1=c2 B.2Q1=Q3 C. 2a1=a3
D. a1 +a2 =1 E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________ (填“正”、“逆”)反应方向移动。
III.在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的物质的量分别如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x mol,当x在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围____________。
(3)若要使右室反应开始时V正逆,x的取值范围____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料.
粗食盐常含有少量Ca2+、Mg2+、SO42﹣等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如图1: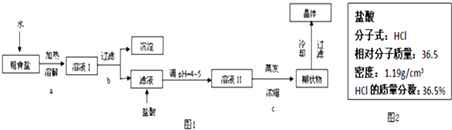
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42﹣离子,从实验室提供的试剂中选出,按滴加顺序依次为
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:;
加入试剂iii:、 .
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 . (从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如图2:
欲用图2所述的浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、、(填仪器名称)
②需量取的浓盐酸的体积为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如图。
2NH3,测得平衡体系中NH3的物质的量分数如图。
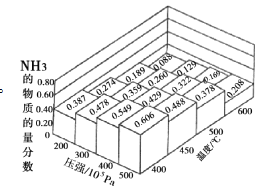
①下列途径可提高氨气产率的是_____(填序号)。
a.采用常温条件 b.采用适当的催化剂 c.将原料气加压 d.将氨液化,不断移去液氨
②上图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1___(选填“>”或“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:N2(g)+2O2(g)=2NO2(g)H=+67.7kJ·mol-1
N2H4(g)+O2g)=N2(g)+2H2O(g)H=-534.0kJ·mol-1
NO2(g)=1/2N2O4(g)H=-28.0 kJ·mol-1
①反应2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的H=_____ kJ·mol-1。
②氨气与次氯酸钠溶液反应生成肼的离子方程式为_________。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
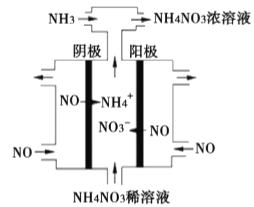
①阴极的电极反应式为__________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为_________。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向装有一定量的稀硫酸中,不断慢慢滴加10%的Ba(OH)2溶液至过量.有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化).其中肯定不正确的是( )
A.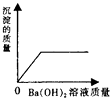
B.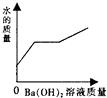
C.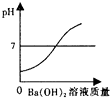
D.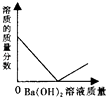
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池叙述正确的是( )
A.水果电池是高效环保的家用电池B.锌锰干电池是一种常用的二次电池
C.锌锰干电池碳棒是负极,锌片是正极D.锌锰干电池工作一段时间后锌外壳逐渐变薄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-)
C.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com