
| A. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 热的纯碱去油污能力更强 | |
| D. | 夏天将食品储藏在冰箱中 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A.存在平衡H2CO3?H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不选;
B、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,故B不选;
C、碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,可以用平衡移动原理来解释,故C不选;
D、将食物放在冰箱里延长保质期,是通过降低温度来减慢反应速率,不能用平衡移动原理来解释,故D选;
故选D.
点评 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.


科目:高中化学 来源: 题型:解答题
 I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
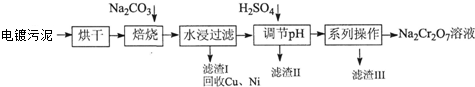
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[来源:] | 183 | 269 | 415 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径在10-9~l0-7m之间 | B. | 是一种纯净物 | ||
| C. | 具有丁达尔效应 | D. | 具有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧一定伴有发光现象 | B. | 燃烧一定会放出热量 | ||
| C. | 燃烧一定要有氧气参加 | D. | 金属在燃烧时化合价一定升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.
如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.
如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com