
| A. | ① | B. | ①⑥ | C. | ①④ | D. | ①④⑥ |
分析 ①根据铁与氯气反应的产物分析;
②根据铁与氯气反应的产物分析;
③根据铁粉和硫粉混合加热即生成硫化亚铁分析;
④硫与氧气中燃烧生成二氧化硫;
⑤铜在氯气中燃烧生成氯化铜;
⑥根据铜和硫粉混合加热即生成硫化亚铜分析;
⑦根据Al与氯气在点燃时能直接化合生成AlCl3分析;
解答 解:①氯气具有强氧化性,和变价金属只生成高价金属氯化物,Fe在Cl2中燃烧只生成FeCl3,单质间反应不能生成FeCl2,故①选;
②FeCl3可由Fe在Cl2中燃烧生成,故②不选;
③硫具有弱氧化性,和变价金属只生成低价金属氯化物,铁粉和硫粉混合加热即生成硫化亚铁,故③不选;
④硫与氧气中燃烧生成二氧化硫,要生成三氧化硫必须有催化剂在情况,故④选;
⑤氯气是强氧化剂,所以铜在氯气中燃烧生成氯化铜,故⑤不选;
⑥硫的氧化性弱,和金属反应生成低价态的金属硫化物,铜和硫粉反应Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,不能通过单质之间的反应直接制取CuS,故⑥选;
⑦Al与氯气反应3Cl2+2Al$\frac{\underline{\;点燃\;}}{\;}$2AlCl3,故⑦不选;
故选D.
点评 本题考查常见金属和非金属的性质,熟练掌握常铁、铝、硫、铜、氯气、氧气等物质的化学性质是解答的关键,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
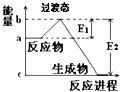 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ①②③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.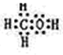 .
.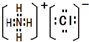 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 Ⅱ.H-I键键能小于H-Cl键键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HI比HCl不稳定 ③HI沸点比HCl高 ④HI沸点比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若n=4,则X是第四周期元素 | |
| B. | 若n=3,则Z可能等于25 | |
| C. | 若X是第四周期元素,则具有“ns2np6nd5”排布的原子一定只有2种 | |
| D. | 若n=4,则X的基态原子一定有10个s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com