
| A�� | MnO2��Ũ���ᷴӦ��Cl2��MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2Cl-+Cl2��+2H2O | |
| B�� | ��������ˮ����Al��OH��3���壺Al3++3H2O=Al��OH��3��+3H+ | |
| C�� | Na2O2����ˮ����O2��Na2O2+H2O=2Na++2OH-+O2�� | |
| D�� | Ca��HCO3��2��Һ������NaOH��Һ��Ӧ��HCO3-+Ca2++OH-=CaCO3��+H2O |
���� A��������ȫ����������ӡ������ӣ�
B��ˮ�����ɽ��壻
C�����ӡ�ԭ�Ӳ��غ㣻
D��NaOH��ȫ��Ӧ������̼��ơ�ˮ��̼�����ƣ�
��� �⣺A��MnO2��Ũ���ᷴӦ��Cl2�����ӷ�ӦΪMnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O����A����
B����������ˮ����Al��OH��3��������ӷ�ӦΪAl3++3H2O?Al��OH��3+3H+����B����
C��Na2O2����ˮ����O2�����ӷ�ӦΪ2Na2O2+2H2O=4Na++4OH-+O2������C����
D��Ca��HCO3��2��Һ������NaOH��Һ��Ӧ�����ӷ�ӦΪHCO3-+Ca2++OH-=CaCO3��+H2O����D��ȷ��
��ѡD��
���� ���⿼�����ӷ�Ӧ����ʽ��д�������жϣ�Ϊ��Ƶ���㣬���շ����ķ�Ӧ�����ӷ�Ӧ����д����Ϊ���Ĺؼ������ظ��ֽⷴӦ��������ԭ��Ӧ�����ӷ�Ӧ���飬ע�����ӷ�Ӧ�б�����ѧʽ�����ʣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 SO2�Ĵ������ǹ�ҵ����������Ĺؼ����裮
SO2�Ĵ������ǹ�ҵ����������Ĺؼ����裮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 2mol C | |
| B�� | 2mol A��1mol B��1mol He�����μӷ�Ӧ�� | |
| C�� | 1mol B��1mol C | |
| D�� | 2mol A��3mol B��3mol C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ʳ�� | B�� | �����Ǽ���ʳ�� | C�� | ����������ʳ�� | D�� | �����Ǽ���ʳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ʳ�� | B�� | ���⡢ţ���Ǽ���ʳ�� | ||
| C�� | ���㡢����������ʳ�� | D�� | ���ס�����Ǽ���ʳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 HS-+H+
HS-+H+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
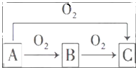 A��B��C����ѧ��ѧ�г������������ʣ�����֮����ת����ϵ��ͼ�����ַ�Ӧ������������ȥ����
A��B��C����ѧ��ѧ�г������������ʣ�����֮����ת����ϵ��ͼ�����ַ�Ӧ������������ȥ����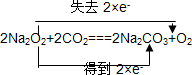 ������˫���ŷ���ʾ������Ӧ�е���ת�Ƶķ������Ŀ����˷�Ӧת��0.5mol����ʱ���������������ڱ�״���µ����Ϊ5.6L������AlCl3��Һ��Ͷ�������ģ�1���е�C���ʣ���Ӧ�����ӷ���ʽΪ2Na2O2+Al3+�TAlO2-+O2��+4Na+��
������˫���ŷ���ʾ������Ӧ�е���ת�Ƶķ������Ŀ����˷�Ӧת��0.5mol����ʱ���������������ڱ�״���µ����Ϊ5.6L������AlCl3��Һ��Ͷ�������ģ�1���е�C���ʣ���Ӧ�����ӷ���ʽΪ2Na2O2+Al3+�TAlO2-+O2��+4Na+���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
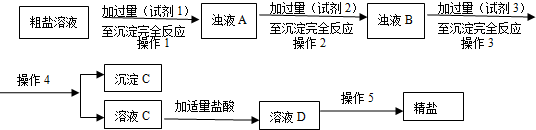
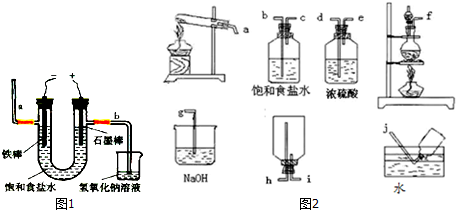
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com