
下列实验步骤与实验事实的相应结论解释正确的是
选项 | 实验步骤与实验事实 | 结论解释 |
A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下述实验方案能达到实验目的的是
选项 | A | B | C | D |
实验 方案 |
食盐水 | 片刻后在Fe电极附近 滴入K3[Fe(CN)6]溶液 |
酸性KMnO4溶液 |
置于光亮处 |
实验 目的 | 验证铁钉发生了 析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:填空题
(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
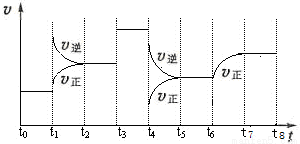
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
A.△S>0
B.逆向能自发进行,且反应速率和平衡常数均较大
C.反应物总能量大于生成物总能量
D.在任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。

查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2 既是氧化剂,又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2参加反应,转移的电子总数为12mol
D.Na2FeO4能消毒杀菌,因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
在分子式为C4H10O的有机物中,含有—OH的同分异构体有(不考虑立体异构)
A.5种 B.4种 C.3种 D.2种
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:填空题
(14分)据图回答下列问题:
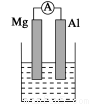
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
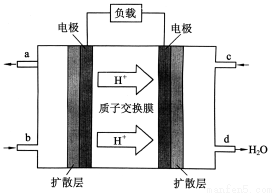
①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是

A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有V正<V逆
C.反应CO(g)+H2O(g) CO2(g)+H2(g) 的ΔH>0
CO2(g)+H2(g) 的ΔH>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com