
【题目】鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法不正确的是( )
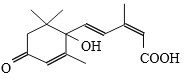
A.其分子式为C15H20O4
B.既能发生加成反应,又能发生取代反应
C.1mol该物质完全燃烧,需要消耗403.2L氧气
D.既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为4Na2FeO4+10H2O===4Fe(OH)3↓+3O2↑+8NaOH。电解制备Na2FeO4装置示意图如图所示。
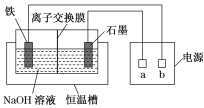
(1)a是电源的________(填“正”或“负”)极。电解时,石墨电极附近溶液的碱性________(填“增强”“减弱”或“不变”)。
(2)铁电极的反应式为_________________________________________________。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如图(电解液体积相同的情况下进行实验)。
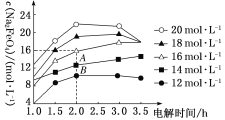
①电解3.0 h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是________(填“增大”“不变”或“减小”)。
②当NaOH起始浓度为16 mol·L-1时,1.0~2.0 h内生成Na2FeO4的速率是__________mol·L-1·h-1。
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用________(填标号)溶液和异丙醇。
A.Fe(NO3)3 B.NH4Cl C.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=a kJ·mol-1
NaCl(aq)+H2O(l)===NaClO(aq)+H2(g) ΔH=b kJ·mol-1
4Na2FeO4(aq)+10H2O(l)===4Fe(OH)3(s)+3O2(g)+8NaOH(aq) ΔH=c kJ·mol-1
反应2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)===2Na2FeO4(aq)+3NaCl(aq)+5H2O(l)的ΔH=_______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关文献记载中涉及的化学知识表述不正确的是( )
A.“以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B.“墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C.“丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D.《本草纲目》中记载:“烧酒非古法也,……,用浓酒和糟入甑,蒸令气上,用器承取滴露。”涉及的操作方法是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,[Cu(NH3) 4]( NO3) 2与液氨混合并加入Cu可制得一种黑绿色晶体。
(1)基态Cu2+核外电子排布式是______。
(2)黑绿色晶体的晶胞如图所示,写出该晶体的化学式:______。
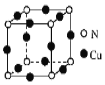
(3)[Cu(NH3)4]2+中配位体的空间结构结构为______
(4)![]() 中N原子轨道的杂化类型是______。与
中N原子轨道的杂化类型是______。与![]() 互为等电子体的一种分子为______(填化学式)。
互为等电子体的一种分子为______(填化学式)。
(5)氨极易溶于水的原因是______。
(6)金属铜的堆积方式如图所示:若该晶胞参数a=658pm,则该晶胞密度为________(列出计算表达式)g·cm-3。
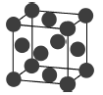 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国计划2020年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(![]() )。用上述提氧原理,理论上,从1 kg
)。用上述提氧原理,理论上,从1 kg ![]() 中可获取105.3g
中可获取105.3g ![]() 。
。
(1)写出![]() 与
与![]() 反应的化学方程式:______________________________________________。
反应的化学方程式:______________________________________________。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含![]() )是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原: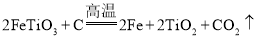 ,
,![]() 通过植物的光合作用可获得
通过植物的光合作用可获得![]() ,化光学方程式为
,化光学方程式为![]() (葡萄糖)
(葡萄糖)![]() 。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
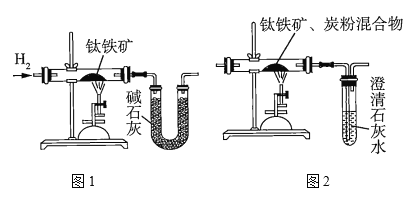
研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是______________________;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为![]() ,炭粉的质量为
,炭粉的质量为![]() ,钛铁矿完全反应后,测得生成
,钛铁矿完全反应后,测得生成![]() 的质量为
的质量为![]() ,则钛铁矿中可提取氧的质量分数为________________。
,则钛铁矿中可提取氧的质量分数为________________。
(4)在钛铁矿提氧过程中科学家们常选用![]() 而不用其他还原剂,其主要原因是______________________。
而不用其他还原剂,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
(1)生成D的反应速率____________。
(2)B的平衡浓度为________。
(3)A的转化率为________。
(4)该温度下的平衡常数K=___。
(5)如果增大反应体系的压强,则平衡体系中C的转化率___。(填“增大”或“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(s)+B(g) ![]() 2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
A.用A表示的反应速率是![]()
B.分别用B、C、D表示反应的速率,其比是1∶2∶1
C.2min末时的反应速率用反应物B来表示的是![]()
D.在2min内用B和C表示的反应速率的值是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com