
某溶液含有K+、Cu2+、Fe3+、Al3+、Fe2+、Cl—、CO2—3、OH—、NO—3、SO2—4中的几种,已知该溶液中各离子物质的量浓度均为0.2mol/L(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g,写出此过程中涉及氧化还原反应的化学方程式____。
(1) 溶液中一定不含有Fe3+(2分)
(2) 溶液中可能含有CO32-或SO42-,或者说同时含有CO32-和SO42- (2分)
(3) Fe2+(1分) 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(2分) 2NO+O2=2NO2 (2分)
(4) 5种(2分)
(5) 3.2g(2分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
解析试题分析:第Ⅰ步中,证明没有Fe3+;第Ⅱ步中表明溶液中可能含有CO32-或SO42-,或者说同时含有CO32-和SO42-;第 Ⅲ中,加入盐酸后,溶液中阴离子种类没有增加,证明没有CO32,但一定含有Cl—,若不含有Cl—则加入盐酸后会增加阴离子的种类。也一定含有NO3—、Fe2+不然的话,也不可能产生在空气中能变成红棕色的无色气体。因此溶液中含有的阴离子一定为:NO3—、SO42-、Cl—;阳离子含有Fe2+,除此之外,根椐溶液呈电中性的原理,再加上溶液中每种离子都为0.2mol/L,表明原溶液中还含有一种离子,这种离子只能是Cu2+。所以总共为五种离子。
依据原子守恒的原理,可知另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为的0.02molCuO和0.01mol Fe2O3,所以总质量为3.2g。
考点:离子共存的相关知识。


科目:高中化学 来源: 题型:填空题
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验 ① 的存在 | ② |
| 第二步 | 继续滴加过量的 ③ 溶液 | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ 溶液 | 检验 ⑥ 的存在 | Ag++Cl- = AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。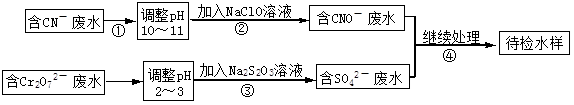 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Cr2O72-和CN-是工业废水中常见的污染物,若利用下列流程可对分别含两种离子的废水综合处理: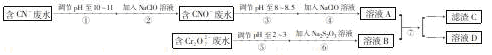
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全。
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式 ,步骤④中NaClO可将CNO- 处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式 。
(2) 步骤⑥的反应为 S2O32-+ Cr2O72-+2H+→SO42-+ Cr3++H2O(未配平),每处理1mol Cr2O72-转移 mole-。
(3) 滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是 。
(4)步骤⑦的操作名称为 ,若该操作在实验室中进行,则所需的的玻璃仪器为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)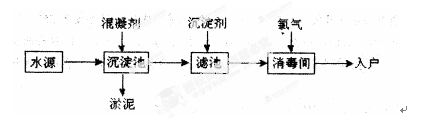
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系 ;
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为: 。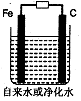
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式: 。
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式: 。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,
现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2 (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
⑶写出反应③中的离子方程式
。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是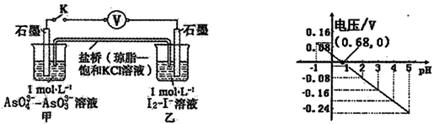
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com