
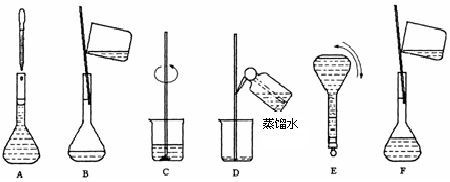
分析 (1)根据m=nM=cVM计算需要氢氧化钠的质量,氢氧化钠固体的称量需要在小烧杯中进行;
(2)根据实验步骤为称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析所需的仪器;
(3)依据(2)判断缺少的仪器;
(4)依据操作图示判断A操作名称;
(5)配制一定物质的量浓度溶液的一般步骤为:称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,据此排序;
(6)玻璃棒在溶解操作时用于搅拌加速固体溶解;移液时,应玻璃棒引流;
(7)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(8)任何操作导致实验失败且无法补救,都需要重新配制.
解答 解:(1)由于实验室无480mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,则根据m=nM=cVM可知需要氢氧化钠的质量m=0.1mol/L×0.5L×40g/mol=2.0g,氢氧化钠固体的称量需要在小烧杯中进行,故答案为:2.0;小烧杯;
(2)根据实验步骤为称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知需要的仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、量筒(可用可不用)、500mL试剂瓶,用不到的仪器为:1000mL容量瓶、漏斗;
故选:de;
(3)依据(2)可知缺少的仪器:500mL容量瓶、托盘天平、小烧杯;
故答案为:托盘天平;500mL容量瓶;小烧杯;
(4)操作A为定容,用胶头滴管逐滴滴加蒸馏水到凹液面最低处与刻度线相切;
故答案为:定容;
(5)配制一定物质的量浓度溶液的一般步骤为:称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的操作顺序为:CBDFAE;
故答案为:CBDFAE;
(6)玻璃棒在溶解操作时用于搅拌加速固体溶解;移液时,应玻璃棒引流;
故答案为:搅拌;引流;
(7)①容量瓶实验前用蒸馏水洗干净,但未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
②定容观察液面时俯视,导致溶液体积偏小,溶液浓度偏高,故选;
③配制过程中遗漏了(4)中步骤D,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
④加蒸馏水时不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低,故不选;
故答案为:②;
(8)加水过量,导致实验失败且不能补救,需要重新配制;
故答案为:重新配制.
点评 本题考查了配制一定物质的量浓度的溶液的方法,注意掌握配制一定物质的量浓度溶液原理和基本操作步骤是解题关键,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,注意误差分析的方法.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴入少量偏铝酸钠溶液:AlO2-+H++H2O=Al(OH)3↓ | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从C(石墨)=C(金刚石)△H=1.9kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,则向含0.1mol/L的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | |
| D. | 2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+ ):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32- )减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L的NaHSO3溶液中含HSO3-的数目为0.1NA | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol,则将1 mol SO2与足量O2混合后充分反应放出的热量为98.3 kJ | |
| C. | 惰性电极电解硫酸铜的溶液,当阳极生成6.4 g铜时,阴极产生的气体在标准状况下为1.12 L | |
| D. | 金属发生吸氧腐蚀时,消耗1 mol O2,转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
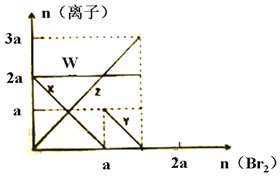 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )| A. | 离子的还原性I->Fe2+>Br- | |
| B. | 四条线与溶液中离子的对应关系是:X-Fe2+、Y-I-、Z-Br-、W-Cl- | |
| C. | 当4a=3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+)c:(Br-)=1:2:8 | |
| D. | 当3a≤2b时,发生的离子方程式:2Fe2++4I-+3Br2═2Fe3++2I2+6Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
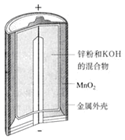 | 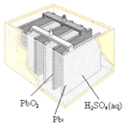 | 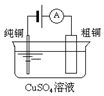 | 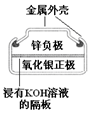 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com