
| 选项 | 现象或事实 | 解释 |
| A | 明矾可用作净水剂 | 明矾能水解生成Al(OH)3 胶体 |
| B | FeCl3溶液可用于腐蚀铜制印刷电路 | FeCl3 溶液能与Cu反应 |
| C | SO2可用于漂白纸浆 | SO2 具有氧化性 |
| D | 酸性或碱性表示食物不宜放在铝锅中久置 | 铝能与酸或碱反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据明矾水溶液中铝离子水解生成具有吸附性的氢氧化铝胶体解答;
B.三价铁离子氧化性强,能够氧化铜生成铜离子;
C.依据二氧化硫的漂白性解答;
D.铝能够与酸和碱反应.
解答 解:A.明矾水溶液中铝离子水解生成具有吸附性的氢氧化铝胶体,能够吸附水中固体杂质颗粒而净水,与胶体的 性质有关,故A正确;
B.三价铁离子氧化性强,能够氧化铜生成铜离子,所以FeCl3溶液可用于腐蚀铜制印刷电路,故B正确;
C.SO2可用于漂白纸浆是因为其具有漂白性,与氧化性无关,故C错误;
D.铝能够与酸和碱反应,所以酸性或碱性表示食物不宜放在铝锅中久置,故D正确;
故选:C.
点评 本题考查了元素化合物知识,侧重考查元素化合物的用途,明确相关物质的性质是解题关键,注意对相关知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
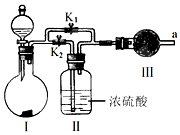
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 影响气体体积大小的主要因素为微粒数目与微粒间的距离 | |
| B. | 可利用MnO2和浓盐酸常温下反应制取氯气 | |
| C. | 相同温度下,在水中Na2CO3的溶解度小于NaHCO3 | |
| D. | 氧化还原反应的本质是存在元素化合价的升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁高温下与足量水蒸气充分反应转移电子数目为3NA | |
| B. | 100 g CaCO3和KHCO3混合固体中CO32-的数目为NA | |
| C. | 实验室用H2O2制备1mol O2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
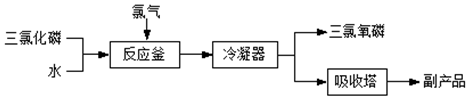
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C12按体积比1:3混合可制得纯净的CHCl3 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| C. | C3H6O2有3种同分异构体,它们均能与钠反应放出氢气 | |
| D. | 人体内的蛋白质分解,最终生成二氧化碳和水排出体外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
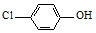 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.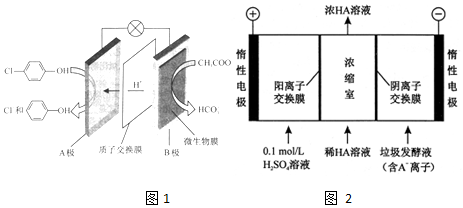
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com