
| A. | 0.35mol | B. | 0.7mol | C. | 0.3mol | D. | 0.5mol |
分析 铜和浓硝酸反应生成硝酸铜、二氧化氮与水,与稀硝酸反应生成硝酸铜、一氧化氮和水,铜失去2个电子形成Cu2+,失去的电子物质的量是铜的2倍,硝酸中N元素的化合价降低,对应的产物NO、NO2为还原产物,根据氮元素守恒n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜原子守恒n[Cu(NO3)2]=n(Cu),两者连列计算铜的物质的量,据此计算.
解答 解:硝酸具有强氧化性,铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着反应进行,硝酸浓度变稀,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,铜失去2个电子形成Cu2+,铜作还原剂,硝酸中N元素的化合价降低,则作氧化剂,硝酸在反应中被还原,则对应的产物NO、NO2为还原产物,标准状况下总体积为6.72L,物质的量为:$\frac{6.72L}{22.4mol/L}$=0.3mol,则n(NO2)+n(NO)=0.3mol①,100mol 10mol•L-1的浓HNO3中,n(HNO3)=1mol,根据氮元素守恒n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=1mol②,将①代入②可得n[Cu(NO3)2]=0.35mol,根据铜原子守恒n[Cu(NO3)2]=n(Cu)=0.35mol,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒、原子守恒为解答的关键,侧重分析与计算能力的综合考查,题目难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | O2-的结构示意图: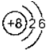 | |
| B. | 四氯化碳的电子式: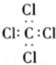 | |
| C. | HClO的结构式为:H-O-Cl | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
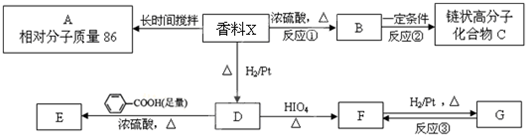

 、C
、C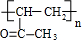 ;
;

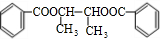 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于0.2mol•L-1 | B. | 等于0.2mol•L-1 | C. | 小于0.2mol•L-1 | D. | 无法估算 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
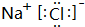 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com