
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
 甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙.(C1、C2、C3为石墨棒)则下列叙述正确的是( )
甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙.(C1、C2、C3为石墨棒)则下列叙述正确的是( )| A、甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B、C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D、甲、丙中溶液的pH值都逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol P4中P-P键的数目为6NA |
| B、1mol Na2O2晶体中含有阴阳离子总数为4NA |
| C、30g SiO2晶体中含有Si-O键数目为2NA |
| D、6g金刚石中含有的碳碳键数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧菜用过的铁锅,放置较长时间出现红棕色斑迹 |
| B、用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量 |
| C、牛奶久置变质腐败 |
| D、用食醋除去水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
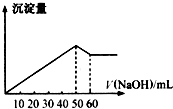 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com