
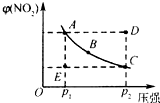
 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).分析 (1)压强越大,气体的反应速率越大;
(2)D点要达平衡,必须降低NO2的百分含量,也就是逆向建立平衡,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等;
(3)由D状态转变为C状态,该反应向逆反应方向移动;
(4)从当快速加压时,平衡未移动,但压强迅速增大,反映在图象上就是纵坐标不变,横坐标不断增大;当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡的角度分析.
解答 解:(1)由于C点的压强大于A点的压强,所以正反应速率A<C,故答案为:<;
(2)当反应处于B状态时,为平衡状态,v正=v逆,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等.D点要达平衡,必须降低NO2的百分含量,也就是逆向建立平衡,从而得出v(正)<v(逆).E点要达平衡,必须提高NO2的百分含量,也就是正向建立平衡,从而得出v(正)>v(逆),故答案为:D;
(3)根据图象知,由D状态转变为C状态,二氧化氮含量减小,该反应向逆反应方向移动,则混合气体的物质的量减小,故答案为:减小;
(4)对于压强的改变,当快速加压时,平衡未移动,但压强迅速增大,反映在图象上就是纵坐标不变,横坐标不断增大;当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡,所以缓慢加压时,NO2的体积百分含量的变化应不断地在平衡曲线上滑动.所以“使E状态从水平方向到达C状态”,应突然加压;“由C沿平衡曲线以达A状态”,应缓慢降压.
故答案为:B.
点评 本题考查化学平衡移动图象题,本题难度不大,本题易错点为D项,注意紧扣“使E状态从水平方向到达C状态后,再沿平衡曲线以达A状态”从坐标和横坐标的变化特点.


科目:高中化学 来源: 题型:选择题
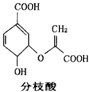
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1 mo1分枝酸最多可与3 mol NaOH发生中和反应 | |
| C. | 分枝酸的分子式为C10H8O6 | |
| D. | 分枝酸分子中含有2种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )
如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )| A. | E、X、L三种元素的非金属性强弱关系为E<L<X | |
| B. | 同浓度的W、R两种元素的最高价氧化物对应水化物的溶液中,pH后者更小 | |
| C. | 元素Z、J对应的单质均能与Y的最高价氧化物对应的水化物反应生成H2,故它们的性质相同 | |
| D. | 元素X、Y、W形成的某化合物的溶液能与W的最高价氧化物对应的水化物反应生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
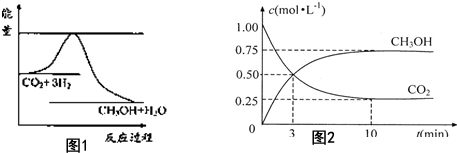 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
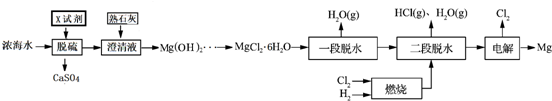
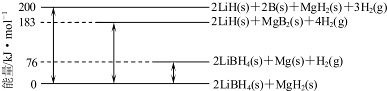
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
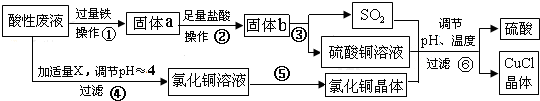
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com