
设NA表示阿伏伽德罗常数的值,下列说法中正确的是
A.1molNH4+所含质子数为10 NA
B.6.8g液态KHSO4中含有0.1NA个阳离子
C.常温常压下,22.4 LSO2所含的分子数为NA
D.常温常压下,32 gO2和O3的混合气体所含原子数为 2NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56(m-n)g | B. | 56(n-m)g | C. | 56ng | D. | 56(m-2n)g |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
若Cmol的AlCl3溶液V1ml 加水稀释至V2ml,稀释后溶液中Cl-物质的量浓度为
A.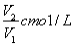 B.
B.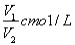 C.
C.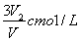 D.
D.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列物质在空气中久置,不会变质的是
A.新制氯水 B.Na2O2 C.漂白粉 D.NaCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
温度为T时,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50s的平均速率v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)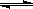 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1
B.若在恒压绝热条件下反应,平衡后nc<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持其它条件不变,加入少量W,平衡将逆向移动 | |
| B. | 保持温度和体积不变,加入少量X,正、逆反应速率均增大 | |
| C. | 保持体积不变,升高温度,正反应速率增大,逆反应速率降低 | |
| D. | 保持温度不变,将体积压缩一半,新平衡时体系压强变为原来的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2)
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2) 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com