
 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=| 2.3g |
| 23g/mol |
| 0.1mol |
| 1L |
| 10-12 |
| 0.1 |


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、为得到较大的晶体颗粒,结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件 |
| B、纸层析中,滤纸作为固定相,展开剂作为流动相 |
| C、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| D、用硝酸银溶液可以鉴别NaCl溶液和NaNO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是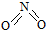 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:
某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①的离子方程式:2Fe3++H2S═2Fe2++S↓+2H+ | ||||
| B、反应②中的阴极反应式为:2H++2e-═H2↑ | ||||
C、该流程的总反应式为:H2S
| ||||
| D、该过程中,能量转化形式有两种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com