
 (1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1
(1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1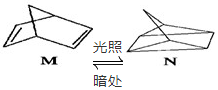
分析 (1)1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出143KJ的热量,则2molH2完全燃烧生成液态水时放出热量为143KJ×4=572kJ,结合物质的状态及焓变书写热化学方程式;
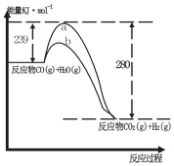
(2)A、其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)反应物的总能量高于生成物的总能量,所以正反应是放热反应;
B、反应物的总能量高于生成物的总能量;
C、使用催化剂,活化能降低;
D、气态水变液态水要放热;
(3)M转化为N是吸热反应,所以N的能量高,不稳定;
(4)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(5)①C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol依据盖斯定律,①-②计算.
解答 解:(1)1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出143kJ的热量,则2molH2完全燃烧生成液态水时放出热量为143kJ×4=572kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1,
故答案为:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1;
(2)A、其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)反应物的总能量高于生成物的总能量,所以正反应是放热反应,所以△H=-41KJ•mol-1
,故错误;
B、反应物的总能量高于生成物的总能量,是放热反应,故正确;
C、使用催化剂,活化能降,所以b用催化剂,故错误;
D、气态水变液态水要放热,所以放出热量小,但反应热变大,故错误;
故选:B;
(3)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(4)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,故答案为:<;
(5)①C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol依据盖斯定律,①-②得可得:C燃烧生成CO的热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ/mol.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,盖斯定律的计算应用,掌握基础是解题关键,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有K+ |
| D | 滴加NaOH溶液加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、高锰酸钾酸性溶液 | B. | 碳酸钠溶液、溴水 | ||
| C. | 新制的银氨溶液溶液、溴水 | D. | 新制氢氧化铜悬浊液、氯化铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com