
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
分析 A.选用酚酞作指示剂,滴定前溶液为无色,滴定后溶液为浅红色;
B.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
C.滴定管从0刻度一直到滴定管口有一段没有刻度的导管;
D.高锰酸钾具有氧化性,腐蚀橡皮管.
解答 解:A.选用酚酞作指示剂,滴定前溶液为无色,滴定后溶液为浅红色,滴定终点的判断:当无色变为浅红色且半分钟内不变色时即为滴定终,故A错误;
B.滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待)偏小,故B正确;
C.滴定管的0刻度在下方,而从0刻度一直到滴定管口还有一段没有刻度的导管,所以液面恰好在10.00ml刻度处时实际溶液体积大于40.00ml,故C错误;
D.高锰酸钾具有氧化性,腐蚀橡皮管,所以量取15.00mLKMnO4溶液不应选择碱式滴定管(乙滴定管),而选择酸式滴定管(甲滴定管),故D错误;
故选B.
点评 本题主要考查了滴定管的使用、酸碱中和滴定,难度不大,注意滴定管的结构特征和使用方法.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加水 | B. | CH3COONa固体 | C. | 升温 | D. | NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素的两原子之间不可能形成离子键 | |
| B. | 离子化合物不可能全部由非金属元素组成 | |
| C. | 含有非极性键的分子不一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:3 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
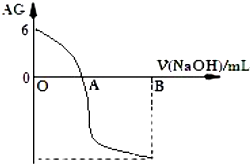
| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.2 mol/L的一元酸HA溶液和0.1 mol/L的NaOH溶液混合,混合液中一定有:c(OH-)+c(A-)=c(H+)+c(Na+) | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-9mol/L,则该溶液的pH一定为5 | |
| C. | 室温下,NaHSO3溶液的pH<7,则溶液中c(SO32-)<c(H2SO3) | |
| D. | Na2CO3溶液与NaHCO3溶液混合一定有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
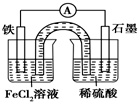
| A. | 原电池工作一段时间后,FeCl2溶液中c(Cl-)增大 | |
| B. | 此电池工作原理与硅太阳能电池工作原理相同 | |
| C. | Fe为正极,石墨上发生的反应为2H++2e-═H2↑ | |
| D. | 该装置中的盐桥完全可用金属导线代替 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com