
·ÖĪö £Ø1£©øł¾ŻŹµŃé²Ł×÷µÄ²½ÖčŅŌ¼°Ćæ²½²Ł×÷ŠčŅŖŅĒĘ÷Č·¶Ø·“Ó¦ĖłŠčŅĒĘ÷£»
£Ø2£©ÅäÖĘFeCl3ČÜŅŗ£¬Fe3+Ņ×Ė®½ā£¬Ė®½āÉś³ÉFe£ØOH£©3µ¼ÖĀČÜŅŗ±ä»ė×Ē£¬ĖłŅŌFeCl3¹ĢĢå¼ÓČėŃĪĖįÖŠŅÖÖĘFeCl3Ė®½ā£»
½«FeCl3ČÜŅŗµĪČė·ŠĖ®ÖŠ²¢Öó·ŠŅ»¶ĪŹ±¼ä£¬Fe3+Ė®½ā£¬æɵƵ½ŗģŗÖÉ«ŅŗĢ壬ŌņøĆŅŗĢåĪŖĒāŃõ»ÆĢś½ŗĢ壻
ĒāŃõ»ÆĢś½ŗĢå¾ßÓŠ¶”“ļ¶ūŠ§Ó¦”¢µēÓ¾”¢¾Ū³ĮµČŠŌÖŹ£¬½«ŅŗĢå¼ÓČČÕōøÉ”¢×ĘÉÕŗó£¬æɵĆFe2O3¹ĢĢ壬¼ÓČėĻõĖįŅųµē½āÖŹŗó½ŗĢå·¢Éś¾Ū³ĮĻÖĻó£»
£Ø3£©¢Ł·“Ó¦ĪļĪŖFeS”¢ŃõĘų”¢Ė®£¬Éś³ÉĪļĪŖFe2£ØS04£©3ŗĶĮņĖį£»
¢ŚCu2SÖŠCuŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+1ÉżøßĪŖ+2£¬SŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ-2ÉżøßĪŖ+6£¬FeŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+3¼Ū½µµĶĪŖ+2£¬ŅŌ“ĖÅäĘ½Ąė×Ó·“Ó¦£»
£Ø4£©ÓÉŠÅĻ¢”°25.00mL 0.049mol/LµÄōĒ°·µÄĖįŠŌČÜŅŗøś×ćĮæµÄĮņĖįĢśČÜŅŗŌŚÖó·ŠĢõ¼žĻĀ·“Ó¦£¬Éś³ÉµÄFe2+Ē”ŗĆÓė24.50mL 0.020mol/LµÄKMnO4ĖįŠŌČÜŅŗĶźČ«×÷ÓĆ”±æÉÖŖ£¬NH2OHŹ§Č„µē×ÓŹżµČÓŚøßĆĢĖį¼ŲµĆµ½µē×ÓŹż£¬ŅŌ“ĖĄ“¼ĘĖć£®
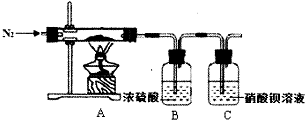
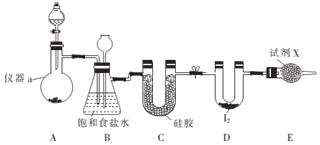
½ā“š ½ā£ŗ£Ø1£©ÅäÖĘ²½ÖčÓŠ¼ĘĖć”¢³ĘĮ攢Čܽā”¢ĄäČ“”¢ŅĘŅŗ”¢Ļ“µÓ”¢¶ØČŻ”¢Ņ”ŌČµČ²Ł×÷£¬Ņ»°ćÓĆĶŠÅĢĢģĘ½³ĘĮ棬ÓĆŅ©³×Č”ÓĆŅ©Ę·£¬ŌŚÉÕ±ÖŠČܽā£ØæÉÓĆĮæĶ²ĮæČ”Ė®£©£¬ĄäČ“ŗó×ŖŅʵ½100mLČŻĮæĘæÖŠ£¬²¢ÓĆ²£Į§°ōŅżĮ÷£¬µ±¼ÓĖ®ÖĮŅŗĆę¾ąĄėæĢ¶ČĻß1”«2cmŹ±£¬øÄÓĆ½ŗĶ·µĪ¹ÜµĪ¼Ó£¬ĖłŅŌŠčŅŖµÄŅĒĘ÷ĪŖ£ŗĶŠÅĢĢģĘ½”¢Ņ©³×”¢ÉÕ±”¢²£Į§°ō”¢100mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü£¬ĖłŅŌÅäÖĘ¹ż³ĢÖŠŠčŅŖµÄ²£Į§ŅĒĘ÷³żĮæĶ²”¢½ŗĶ·µĪ¹Ü”¢ÉÕ±Ķā£¬»¹ŠčŅŖ100mLČŻĮæĘ攢²£Į§°ō£»
¹Ź“š°øĪŖ£ŗ100mLČŻĮæĘ攢²£Į§°ō£»
£Ø2£©ĪŖ·ĄÖ¹Fe3+Ė®½ā£¬ŹµŃéŹŅŌŚÅäÖĘFeCl3µÄČÜŅŗŹ±£¬³£½«FeCl3¹ĢĢåĻČČÜÓŚŃĪĖįÖŠ£¬Č»ŗóŌŁÓĆÕōĮóĖ®Ļ”ŹĶµ½ĖłŠčµÄÅØ¶Č£»
½«FeCl3ČÜŅŗµĪČė·ŠĖ®ÖŠ²¢Öó·ŠŅ»¶ĪŹ±¼ä£¬Fe3+Ė®½ā£ŗFe3++3H2OØTFe£ØOH£©3£Ø½ŗĢ壩+3H+£¬æɵƵ½ŗģŗÖÉ«ŅŗĢ壬ŌņøĆŅŗĢåĪŖĒāŃõ»ÆĢś½ŗĢ壻
ĒāŃõ»ÆĢś½ŗĢå¾ßÓŠ¶”“ļ¶ūŠ§Ó¦”¢µēÓ¾”¢¾Ū³ĮµČŠŌÖŹ£¬½«ŅŗĢå¼ÓČČÕōøÉ”¢×ĘÉÕŗó£¬æɵĆFe2O3¹ĢĢ壬¼ÓČėĻõĖįŅųµē½āÖŹŗó½ŗĢå·¢Éś¾Ū³ĮĻÖĻ󣬹ŹŃ”ad£»
¹Ź“š°øĪŖ£ŗFe3++3H2OØTFe£ØOH£©3£Ø½ŗĢ壩+3H+£»a”¢d£®
£Ø3£©¢Ł·“Ó¦ĪļĪŖFeS”¢ŃõĘų”¢Ė®£¬Éś³ÉĪļĪŖFe2£ØS04£©3ŗĶĮņĖį£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ4FeS2+15O2+2H2O$\frac{\underline{\;Ļø¾ś\;}}{\;}$2Fe2£ØS04£©3+2H2S04£¬
¹Ź“š°øĪŖ£ŗ4FeS2+15O2+2H2O$\frac{\underline{\;Ļø¾ś\;}}{\;}$2Fe2£ØS04£©3+2H2S04£»
¢ŚCu2SÖŠCuŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+1ÉżøßĪŖ+2£¬SŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ-2ÉżøßĪŖ+6£¬FeŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+3¼Ū½µµĶĪŖ+2£¬ÓÉŌŖĖŲŹŲŗćŗĶµēŗÉŹŲŗćæÉÖŖĪ“ÖŖĪļĪŖH+£¬ŌņøĆĄė×Ó·“Ó¦ĪŖCu2S+10Fe3++4H2O$\frac{\underline{\;Ļø¾ś\;}}{\;}$2Cu2++10Fe2++8H++S042-£¬
¹Ź“š°øĪŖ£ŗ1£»10£»4£»2£»10£»8H+£»1£»
£Ø4£©ÓÉ25.00mL 0.049mol/LµÄōĒ°·µÄĖįŠŌČÜŅŗøś×ćĮæµÄĮņĖįĢśČÜŅŗŌŚÖó·ŠĢõ¼žĻĀ·“Ó¦£¬Éś³ÉµÄFe2+Ē”ŗĆÓė24.50mL 0.020mol/LµÄKMnO4ĖįŠŌČÜŅŗĶźČ«×÷ÓĆæÉÖŖ£¬
NH2OHŹ§Č„µē×ÓŹżµČÓŚøßĆĢĖį¼ŲµĆµ½µē×ÓŹż£¬
ÉčōĒ°·µÄŃõ»Æ²śĪļÖŠNŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖx£¬
Óɵē×ÓŹŲŗćæÉÖŖ£¬25.00”Į0.001L”Į0.049mol/L”Į£Øx+1£©=24.50”Į0.001L”Į0.020mol/L”Į£Ø7-2£©£¬
½āµĆx=1£¬
ōĒ°·µÄŃõ»Æ²śĪļŹĒN2O£¬
¹Ź“š°øĪŖ£ŗ+1£®
µćĘĄ ±¾ĢāŅŌŠÅĻ¢µÄŠĪŹ½æ¼²éŃõ»Æ»¹Ō·“Ó¦£¬Ć÷Č··¢ÉśµÄ·“Ó¦¼°·“Ó¦ÖŠŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»Æ¼“æɽā“š£¬ĢāÄæÄѶČÖŠµČ£¬£Ø4£©ĪŖ½ā“šµÄÄŃµć£¬×¢Ņā°ŃĪÕµē×ÓŹŲŗćŌŚ¼ĘĖćÖŠµÄÓ¦ÓĆ£®


 æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø
æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĮņĖįŃĒĢśļ§ÓÖ³ĘĪŖĦ¶ūŃĪ£¬ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ęä×é³ÉæɱķŹ¾ĪŖx£ØNH4£©2S04•yFeS04•zH20£®Ä³ŠĖȤŠ”×éĢ½¾æ×é³ÉÖŠµÄx”¢y”¢zµÄŹżÖµ£®
ĮņĖįŃĒĢśļ§ÓÖ³ĘĪŖĦ¶ūŃĪ£¬ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ęä×é³ÉæɱķŹ¾ĪŖx£ØNH4£©2S04•yFeS04•zH20£®Ä³ŠĖȤŠ”×éĢ½¾æ×é³ÉÖŠµÄx”¢y”¢zµÄŹżÖµ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
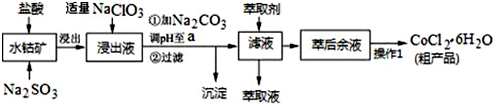
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Co£ØOH£©2 | Al£ØOH£©3 | Mn£ØOH£©2 |
| æŖŹ¼³Įµķ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ĶźČ«³Įµķ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
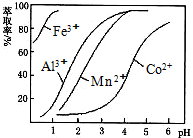
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
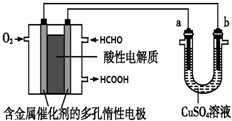
| A£® | µ±a”¢b¶¼ŹĒĶ×öµē¼«Ź±£¬µē½āµÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗ2CuSO4+2H2O $\frac{\underline{\;Ķصē\;}}{\;}$2H2SO4+2Cu+O2”ü | |
| B£® | Č¼ĮĻµē³Ų¹¤×÷Ź±£¬Õż¼«·“Ó¦ĪŖ£ŗO2+2H2O+4e-ØT4 OH- | |
| C£® | µ±Č¼ĮĻµē³ŲĻūŗÄ2.24L ¼×Č©ĘųĢåŹ±£¬µēĀ·ÖŠĄķĀŪÉĻ×ŖŅĘ2mol e- | |
| D£® | Č¼ĮĻµē³Ų¹¤×÷Ź±£¬øŗ¼«·“Ó¦ĪŖ£ŗHCHO+H2O-2e-ØTHCOOH+2H+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
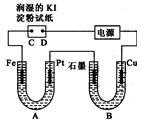 µē½ā×°ÖĆČēĶ¼ĖłŹ¾£®Ķ¼ÖŠB×°ÖĆŹ¢1000mL 3mol•L-1Na2SO4ČÜŅŗ£¬A×°ÖĆÖŠŹ¢1000mL 3mol•L-1AgNO3ČÜŅŗ£®ĶصēŅ»¶ĪŹ±¼äŗó£¬ČóŹŖµÄµķ·ŪKIŹŌÖ½µÄC¶Ė±äĄ¶É«£®ŹŅĪĀĻĀ£¬Čō“Óµē½āæŖŹ¼µ½Ź±¼äĪŖtŹ±£¬A”¢B×°ÖĆÖŠ¹²ŹÕ¼Æµ½16.8mL£Ø±ź×¼×“æö£©ĘųĢ壮Čōµē½ā¹ż³ĢÖŠĪŽĘäĖūø±·“Ó¦·¢Éś£¬ĒŅČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©
µē½ā×°ÖĆČēĶ¼ĖłŹ¾£®Ķ¼ÖŠB×°ÖĆŹ¢1000mL 3mol•L-1Na2SO4ČÜŅŗ£¬A×°ÖĆÖŠŹ¢1000mL 3mol•L-1AgNO3ČÜŅŗ£®ĶصēŅ»¶ĪŹ±¼äŗó£¬ČóŹŖµÄµķ·ŪKIŹŌÖ½µÄC¶Ė±äĄ¶É«£®ŹŅĪĀĻĀ£¬Čō“Óµē½āæŖŹ¼µ½Ź±¼äĪŖtŹ±£¬A”¢B×°ÖĆÖŠ¹²ŹÕ¼Æµ½16.8mL£Ø±ź×¼×“æö£©ĘųĢ壮Čōµē½ā¹ż³ĢÖŠĪŽĘäĖūø±·“Ó¦·¢Éś£¬ĒŅČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©| A£® | µē×ÓĮ÷¶ÆµÄ·½Ļņ£ŗFe”śPt”śŹÆÄ«”śCu | |
| B£® | BÖŠŹÆÄ«ÉĻæÉÄÜÓŠŗģÉ«ĪļÖŹĪö³ö | |
| C£® | Čō°ŃFeµē¼«øijÉAgµē¼«£¬æÉĻņPtÉĻ¶ĘŅų | |
| D£® | tŹ±AČÜŅŗµÄpHĪŖ3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 15 | B£® | 16 | C£® | 17 | D£® | 18 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹŹĮæÉćČėÓĶÖ¬£¬ÓŠÖśÓŚČĖĢåĪüŹÕ¶ąÖÖÖ¬ČÜŠŌĪ¬ÉśĖŲŗĶŗśĀܲ·ĖŲ | |
| B£® | ĄūÓĆÓĶÖ¬ŌŚ¼īŠŌĢõ¼žĻĀµÄĖ®½ā£¬æÉŅŌÉś²śøŹÓĶŗĶ·ŹŌķ | |
| C£® | Ö²ĪļÓĶĶعżĒā»ÆæÉŅŌÖĘŌģÖ²ĪļÄĢÓĶ£ØČĖŌģÄĢÓĶ£© | |
| D£® | Ö¬·¾ŹĒÓŠ»śĢå×éÖÆĄļ“¢“ęÄÜĮæµÄÖŲŅŖĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com