
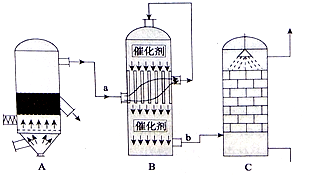
分析 (1)依据接触法制硫酸的工业流程和设备反应分析判断;硫铁矿与氧气在高温下煅烧反应;
(2)A.依据接触法制硫酸的工业流程和三个设备反应分析判断;
B.依据三氧化硫吸收的方法是利用浓硫酸吸收,防止形成酸雾,阻止吸收分析判断;
C.根据S元素守恒,利用关系式计算;
D.二氧化硫生成三氧化硫的反应是放热的可逆反应,运用平衡移动的原理判断;
E.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热;
(3)氨碱法中CO2的来源于合成氨工业的废气,联合制碱法中CO2来源于石灰石煅烧;
(4)根据根据“联合制碱法”的反应方程式计算;
(5)联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取碳酸氢钠,碳酸氢钠受热分解生成纯碱.
解答 解:(1)A设备是硫铁矿与氧气在高温下煅烧反应在沸腾炉中进行,反应的方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:沸腾炉;4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)A.依据接触法制硫酸的工业流程和三个设备分析判断,二氧化硫的接触氧化是在接触室中发生的,故A正确;
B.设备C中用98.3%的H2SO4来吸收SO3的原因是,用水吸收易形成酸雾阻止三氧化硫的吸收,故B正确;
C.根据S元素守恒,利用关系式可知,
设黄铁矿m克,含硫为48%m克,含FeS2为$\frac{120}{64}$×48%m克,据比例关系:
FeS2------------------2S
$\frac{120}{64}$×48%m×(1-2%) 48%m×98%
则S损失为:$\frac{48%m-48%m×98%}{48%m}$×100%=2%,故C正确;
D.二氧化硫生成三氧化硫的反应是放热的可逆反应,升高温度平衡向吸热方向移动,降低SO2的转化率,故D错误;
E.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热,而不是利用SO3转化为H2SO4时放的热量,故E错误;
故答案为:DE;
(3)CO2是制碱工业的重要原料,氨碱法中CO2的来源于合成氨厂用水煤气制取氢气时的废气,联合制碱法中CO2来源于高温煅烧石灰石的产物,
故答案为:合成氨厂;煅烧石灰石;
(4)氨碱法的原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,总反应为:2NH3+CO2+H2O+2NaCl(饱和)=Na2CO3+2NH4Cl
原子利用率=$\frac{106}{17×2+44+18+58.5×2}$×100%=$\frac{106}{213}$×100%≈49.7%,
故答案为:49.7%;
(5)联合制碱法是在氨的饱和NaCl溶液中二氧化碳气体,反应生成碳酸氢钠,解热碳酸氢钠即可制备碳酸钠,反应的有关方程式为NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查了工业制硫酸、联合制碱法原理,题目难度中等,明确发生反应原理为解答关键,注意掌握工业制硫酸、联合制碱法的原理、设备等知识,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | KNO3(NaCl) | AgNO3溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S) | |
| B. | 往氯化铵溶液中加水$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值变大 | |
| C. | 0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,所得溶液呈现碱性:c(Na+)>c(HA)c(A-)>c(OH-)>c(H+) | |
| D. | pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu | |
| B. | 盐酸与饱和的澄清石灰水反应:H++OH-══H2O | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+══Ca2++CO2↑+H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
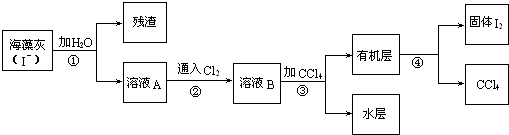
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体中一定含有SCN- | B. | Fe3+的氧化性比I2的氧化性强 | ||
| C. | Fe3+被I-还原 | D. | Fe2+是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com