
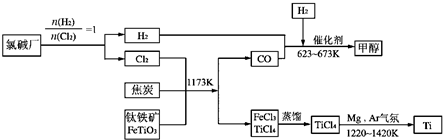
 Ti(s)+Cl2(g)=
Ti(s)+Cl2(g)= TiCl4(l)△H=-385kJ?mol-1
TiCl4(l)△H=-385kJ?mol-1

科目:高中化学 来源: 题型:单选题
| 序号 | 实验方案 | 现象、结论 |
| A | 加入盐酸 | 产生无色气体,含铝、铁、镁三种元素 |
| B | 加入NaOH 溶液 | 有无色气体产生,含有铝元素 |
| C | 加入盐酸后,所得溶液中再加入少量NaOH溶液 | 产生白色沉淀,含有镁元素 |
| D | 加入KSCN 溶液 | 溶液呈血红色,含有铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
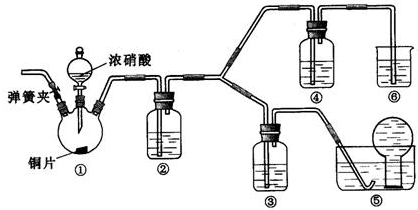
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
(1)①写出NaHSO4在水溶液中的电离方程式______.
②CO2通入足量氢氧化钠溶液反应的离子反应方程式______.
③OH-+H+=H2O改写为化学方程式______.
Cu2++Fe=Fe2++Cu改写为化学方程式______.
(2)①同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为______.
②现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数用NA表示,则该气体所含原子总数为______个.
(3)下列实验操作中不正确的是______(多选).
A.用分液的方法分离水和汽油的混合物
B.用过滤的方法分离饱和食盐水与沙子的混合物
C.蒸馏时,应使温度计水银球插入液面以下
D.蒸发结晶时应将溶液蒸干后再停止加热
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体.
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com