
(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
(1)加水前导电能力为零的理由是:
(2)a、b、c、d四点醋酸的电离度大小顺序是
(3)a、b、c、d四点溶液PH值大小顺序是
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)
| A.加水 | B.加NaOH | C.加H2SO4 | D.加Na2CO3 |
科目:高中化学 来源: 题型:
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
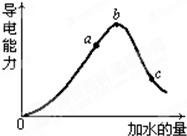 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 |
| 不填 | 不填 |
| 加水 |
|
| 不填 |
| 加盐酸 | 不填 |
|
|
| 加少量氢氧化钠固体 | 不填 | 不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____10C(H+)乙(填“大于”、“小于”或 “等于”),
查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市高二下学期期末测试化学 题型:选择题
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示。下列说法不正确的是

A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com