
��18�֣�
����֪��Na2S2O3 + H2SO4 = Na2SO4 + SO2�� + S�� + H2Oijͬѧ̽��Ӱ�������������ϡ���ᷴӦ���ʵ�����ʱ�����������ϵ��ʵ�飺
ʵ����� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
�� | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
�� | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
�� | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
��1����ʵ��١��ڿ�̽�� �Է�Ӧ���ʵ�Ӱ�죬���V1= ��V2= ��V3= ��
��2��ʵ��١��ۿ�̽�� �Է�Ӧ���ʵ�Ӱ�죬���V4= ��V5= ��
��3�������йظõ����������ȷ����
A��ʵ��ǰ��Ӧ����һ�Ű�ֽ���ú�īˮ���ڰ�ֽ�ϻ���dzһ�µġ�+���֣�������ƿ�ײ���ʵ���м�¼��Ӧ��ʼ�������Ļ��ǽ���ƿ�ײ��ġ�+���ָպ���ȫ�ڸ������ʱ��
B����ʵ������ļ�����������Ͳ���¶ȼ�
C��ʵ��ʱ��Ӧ�Ƚ���ȡ��Na2S2O3 ��H2SO4��Һ��ϣ�Ȼ��������Ӧ�¶ȵ���ˮԡ�з�Ӧ����¼ÿ�鷴Ӧ����ʱ��
D��ÿ��ʵ��������Ҫ��֧��Ͳ
��4��ʵ�������Ϊʲô���ò���һ��ʱ���ڷų�SO2�����������ʾ�÷�Ӧ�Ļ�ѧ��Ӧ���ʵĴ�С�� ��
�����÷�Ӧ��I2+2Na2S2O3=Na2S4O6+2NaI���Զ����ⶨ�������������(Mr=158)�Ĵ��ȣ����ڳ�ȡWg��������ƹ�����Ʒ�����250mL����Һ��ȡ25.00mL������ƿ�У�����ָʾ�����ú���I2Ϊamol/L�ĵ�ˮ�ζ������ĵ�ˮbmL����
��1��������еζ���Ӧ��ѡ����� ����ʽ���ʽ���ζ��ܣ��ζ�ǰ����ѡ�� ��ָʾ�����ζ��յ������Ϊ
��2�����ڸõζ�ʵ����йز�������������ȷ���� ��
A���ζ�ǰ��Ӧ�Եζ��ܡ���ƿ������ϴ����
B���ζ������У���Һ�ε���ƿ�⣬��ʹ������ƫ��
C���ζ����ڵζ���ʼʱ���������ݣ��ζ���ɺ�������ʧ��������õĴ��Ƚ���ƫС
D���ζ�ǰ���Ӷ������ζ�����ʱ���Ӷ�����������õĴ��Ƚ���ƫС
��3����Ʒ����������ƴ��ȵı���ʽΪ ��
��10�֣�
��1���¶ȣ�1�֣��� 10.0��10.0��0��ȫ��2�֣�
��2��Ũ�ȣ���дc(H+)����1�֣��� 10.0��6.0��ȫ��2�֣�
��3��AD��2�֣�
��4��SO2������ˮ����ȷ�����������2�֣�
��8�֣�
��1���ᣨ1�֣������ۣ�1�֣���Һ�պó�����ɫ���Ұ���Ӳ���ȥ��2�֣�
��2��BD��2�֣�
��3��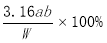 ��2�֣�
��2�֣�
��������
�����������1���ɱ����������ݿ�֪��ʵ��١����¶Ȳ�ͬ��ʵ��١�������̽���¶ȶԷ�Ӧ����Ӱ�죬��V1=10.0ml�� V2=10.0ml�� V3=0ml����2��ʵ��١����¶���ͬ����ȡϡ��������ͬ����ʵ��١�������̽��c(H+)�Է�Ӧ����Ӱ�죬��V4=10.0ml�� V5=6.0ml����2�� A��ʵ��ǰ��Ӧ����һ�Ű�ֽ���ú�īˮ���ڰ�ֽ�ϻ���dzһ�µġ�+���֣�������ƿ�ײ���ʵ���м�¼��Ӧ��ʼ�������Ļ��ǽ���ƿ�ײ��ġ�+���ָպ���ȫ�ڸ������ʱ�䣬��ʱ������жϷ�Ӧ���ʣ���A����ȷ��B����ʵ������ļ�����������Ͳ���¶ȼƣ���Ӧ���������B�����C��ʵ��ʱ��Ӧ�Ƚ���ȡ��Na2S2O3 ��H2SO4��Һ��ϣ���Ϻ������ѿ�ʼ��Ӧ���ʲ�Ӧ����ϣ�Ӧ�÷�Һ©��������ӣ�Ȼ��������Ӧ�¶ȵ���ˮԡ�з�Ӧ����¼ÿ�鷴Ӧ����ʱ�䣬��C�����ʵ��Ҫ�ֱ���ȡNa2S2O3��Һ��ϡH2SO4��������ʱ�ʵ��Ӧ�õ���ֻ��Ͳ����D����ȷ������ѡAD����4���÷�Ӧ������SO2����������ˮ���ʲ����ò���һ��ʱ���ڷų�SO2�����������ʾ�÷�Ӧ�Ļ�ѧ��Ӧ���ʵĴ�С����1����ˮ�����ԣ���Ӧ����ʽ�ζ��ܣ����������������Ӧ�õ�����ָʾ�����ζ��յ�����Ϊ����Һ�պó�����ɫ���Ұ���Ӳ���ȥ����2��A����ƿ��Ӧ��ϴ�����ô�װҺ��ϴ����ᵼ�����ĵ�ˮ���ƫ��������ҺŨ��ƫ��A�����B���ζ������У���Һ�ε���ƿ�⣬��ᵼ���������ƫ��ʹ������ƫ��B����ȷ��C���ζ����ڵζ���ʼʱ���������ݣ��ζ���ɺ�������ʧ�����ʹ������Һ���ƫ�ʻ�ʹ���ս��ƫ�ߣ���C�����D���ζ�ǰ���Ӷ������ζ�����ʱ���Ӷ�������ᵼ�µζ���������ƫС���ʻᵼ�����ý��ƫ�ͣ���D����ȷ������ѡBD����3���������������ݿ�֪��Ʒ����������ƴ��ȵı���ʽΪ ��
��
���㣺��ѧ�ۺ�ʵ�顣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�Ϻ����������߶���һѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڡ�þ����þ�����������ⶨ���У����ʵ��IJⶨ���ƫ�ߣ����ܵ�ԭ����____________(ѡ����)��
a��װ��©�� b��δ��ȴ�����¼�����
c��þ���к�������þ d��ĩ����ʱ�����ܵ�Һ�����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�������
��5�֣���1.0 mol��L��1 CuSO4��Һ��a mol��L��1H2SO4��Һ�������ϣ���������Һ��������ڻ��ǰ����Һ�����֮�ͣ������Һ��c(SO42��)��1.5mol��L��1���Լ��㲢��ա�
��1��ԭ��Һ��a =______mol��L��1�����Һ��c(Cu2+)��_____mol��L��1��c(H+)��_____ mol��L��1��
��2������Һ�м����������ۣ����㹻��ʱ�䲢��ֽ������������ʣ�࣬���跴Ӧ����Һ������䣨������Fe2+������������ʱ��Һ��c(Fe2+)�� ________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й���Һ��ɵ�������������
A����ɫ��Һ�п��ܴ�������Al3����NH4+��Cl����OH��
B��������Һ�п��ܴ�������Na����ClO����SO42-��I��
C����������Һ�п��ܴ�������Na����K����Cl����HCO3-
D����ɫ��Һ�п��ܴ�������Fe3����K����Cl����SCN-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У����ڵ�������ܵ������
A��ͭƬ B��������Һ C�����ڵ��Ȼ��� D�������Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�ס���������̬���������м���Է�������С���ң����������ܶ�����ͬ״����H2�ܶȵ�13�����ѱ�״����4.48L�û������ͨ����������ˮ�У���ˮ����2.8g���������й������������
A����һ�������� B�������ʵ���Ϊ0.1mol
C�������������ҵĿ��ܽṹ��3�� D���ҵ�����Ϊ2.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����H��0����S��0�ķ�Ӧ�κ��������Ƿ��Է���Ӧ��
B����N2(g)+3H2(g) 2NH3��g����H=��d kJ/mol������ij������Ͷ��1 mol N2��3 mol H2��ַ�Ӧ�ų�����С��d kJ
2NH3��g����H=��d kJ/mol������ij������Ͷ��1 mol N2��3 mol H2��ַ�Ӧ�ų�����С��d kJ
C��һ���¶��£��ڹ̶�����ܱ������У�������Ӧ��2SO2(g)+O2(g) 2SO3(g) ��H��0����v��(SO2)= v��(SO3)ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬
2SO3(g) ��H��0����v��(SO2)= v��(SO3)ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬
D��H2��ȼ���ȡ�H=-285.8 kJ/mol��������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2(g)��O2(g)==2H2O(g) ��H����571.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
(7��)�����£���0.01 mol CH3COONa��0.002 mol HCl����ˮ���γ�1 L�Ļ����Һ��
��1������Һ�д���������ƽ����ϵ���õ��뷽��ʽ�����ӷ���ʽ��ʾ
�� �� ��
��2������Һ�У�Ũ��Ϊ0.01 mol/L�������� ��Ũ��Ϊ0.002 mol/L�������� ��
��3�� �� �����������ʵ���֮�͵���0.01 mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�Ĵ�ʡ��֦���и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��Ӧ��3A(g)��B(g) C(s)��4D(g) ��H��0����ͼ��a��b��ʾһ�������£�D�����������ʱ��t�ı仯�������Ҫʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ��
C(s)��4D(g) ��H��0����ͼ��a��b��ʾһ�������£�D�����������ʱ��t�ı仯�������Ҫʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ��

������B��Ũ�� �����߷�Ӧ�¶�
����С��Ӧ�������������ѹ�� �ܼ������
A���٢� B���٢� C���ڢ� D���ۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com