
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
分析 A.根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据总反应方程式判断;
B.尾气为SO2气体,可用来制取硫酸;
C.氧化还原反应中,元素化合价降低的反应物作氧化剂;
D.电解精炼铜的过程中,阳极溶解的不一定都是铜.
解答 解:A.用黄铜矿进行铜的冶炼,最终产物为Cu、SO2和FeO,所以反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由1molCuFeS2制取1molCu时,共消耗2.5molO2,故A错误;
B.在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫的制取硫酸的原料,所以冶炼过程中的尾气可用来制硫酸,故B正确;
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,故C错误;
D.电解精炼铜的过程中,阳极溶解的不都是铜,比铜活泼的金属也会溶解,所以每转移1mol电子时,阳极溶解铜的质量不是32g,故D错误.
故选B.
点评 本题考查金属的冶炼以及氧化还原有关知识,题目难度不大,注意分析C项中各元素的化合价的变化特点,以正确分析氧化剂和还原剂.


科目:高中化学 来源: 题型:选择题
| A. | 用食醋和石灰水验证鸡蛋壳中含有碳酸钙 | |
| B. | 将淀粉在唾液淀粉酶的作用下水解 | |
| C. | 用米汤检验食盐中是否加了碘 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
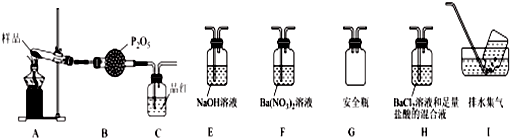
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于反应2AB(g)?A2(g)+B2(g),当容器中AB与A2的体积比不随时间变化,说明反应一定达到平衡状态 | |
| B. | 对于反应N2(g)+3H2(g)?2NH3(g),当1个N≡N键断裂的同时3个H-H键形成,说明反应一定达到平衡状态 | |
| C. | 在恒温,恒容密闭容器中如下反应:2HI(g)?H2(g)+I2(g)混合气体颜色不在变化,说明反应一定达到平衡 | |
| D. | 在恒温,恒容密闭容器中如下反应:X2(g)+Y2(g)?2Z(g)+W(s),当混合气体的平均相对分子质量或压强不随时间的变化而变化,说明反应一定达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
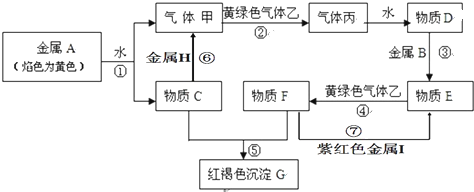
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
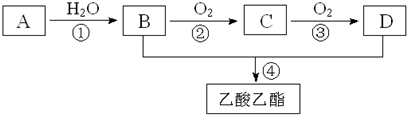
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com