
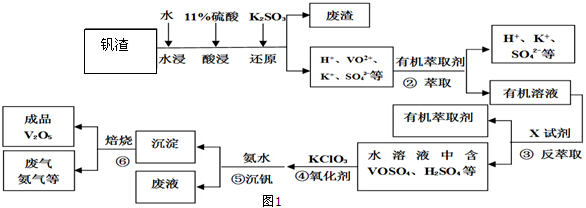
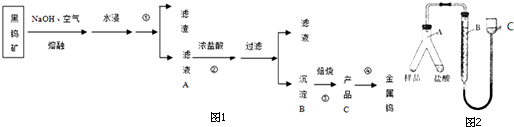
分析 钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)根据化合价代数和为0确定化合价;废钒催化剂的主要成分中二氧化硅不溶于酸;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;提高②中萃取效率还可多次连续萃取;
(4)用化合价升降法配平方程式;
(5)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
(6)在电解池的阴极上是阳离子得电子发生还原反应,在阳极上是阴离子发生失电子的氧化反应;原电池的正极发生还原反应;氯气可以和强碱反应生成氯化钠、次氯酸钠和水,根据得失电子守恒计算理论上最多能产生NaClO的质量.
解答 解:钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)氮的化合价为-3价,氢得化合价为+1价,氧的化合价为-2价,设(NH4)2V6O16中钒中V元素的化合价为x,根据化合价代数和为0得:[-3+1×(+4)]×2+6x+(-2)×16=0,解得x=+5,二氧化硅不和硫酸反应,故废渣中含二氧化硅,
故答案为:+5;SiO2;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,故答案为:稀硫酸;
(3))②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),即Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入碱(具体碱均可)中和硫酸使平衡正移,提高②中萃取效率还可采取多次连续萃取,
故答案为:加入碱(具体碱均可)中和硫酸使平衡正移、多次连续萃取;
(4)氯元素化合价从+5→-1,化合价降低6,钒化合价从+4→+5,化合价升高1,二者最小公倍数为6,把变价元素配平,初步配平为:ClO3-+6VO2++H+→6VO3++Cl-+H2O,根据氧原子守恒确定H2O前系数为3,氢离子前系数为6,故配平后为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1;6;6;6;1;Cl-;3;H2O;
(5)铝与五氧化二钒反应生成钒与氧化铝,反应反应方程式为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,故答案为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,
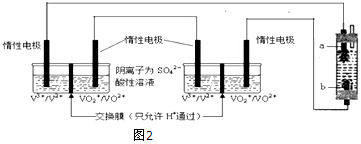
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电解池的下端产生的是氯气,上端产生的是氢气,电解池的阴极上是阳离子氢离子得电子发生得电子的还原反应,生成氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,生成氯气,所以a是阴极,b是阳极生成Cl2,原电池的正极得到电子发生还原反应,全钒液流储能电池正极的电极反应式为:VO2++e-+2H+=VO2++H2O,制取消毒液所涉及反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,每生成1molNaClO转移1mol电子,若通过消毒液发生器的电子为0.2mol,理论上最多能产生NaClO的质量为0.2mol×74.5g/mol=14.9g,
故答案为:阳;VO2++e-+2H+=VO2++H2O;14.9.
点评 本题考查了流程分析判断、物质性质和实验设计的方法应用、题干信息分析判断能力,侧重考查物质的分离提纯、电解反应、电极产物的分析应用、工艺流程的理解,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
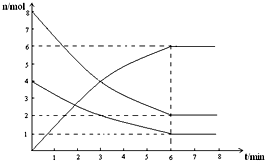 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 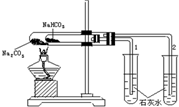 用如图装置比较Na2CO3与NaHCO3的稳定性 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. | 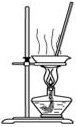 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 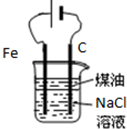 用如图装置制取Fe(OH)2沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com