
【题目】在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是

A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
【答案】C
【解析】
A、若两者恰好反应,则生成物是CH3COONa,CH3COONa为强碱弱酸盐,水解后溶液的pH>7,而M点的pH=7,说明醋酸过量,故A错误;
B、滴定前c(CH3COOH)=c(NaOH)=0.1 mol·L-1,NaOH是强碱,溶于水完全电离,但CH3COOH为弱酸,溶于水部分电离,所以滴定前,酸中c(H+)小于碱中c(OH-),故B错误;
C、在常温下,根据初始pH=13可知NaOH溶液中氢离子浓度为10-13mol·L-1,则c(NaOH)=0.1 mol·L-1,故C正确;
D、据分析c(NaOH)=0.1 mol·L-1,则N点时,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,此时pH<7,说明CH3COOH的电离大于CH3COONa的水解,但两者程度都很小,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故D错误;
综上所述,本题应选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种测定O2含量的气体传感器如图所示。传感器工作时, 仅Ag+能在α-AgI晶体里迁移,O2透过聚四氟乙烯进入传感器、AgI的物质的量增加。下列有关说法不正确的是
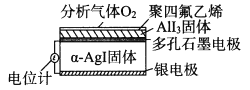
A. 正极反应为I2+2Ag++2e-=2AgI B. 负极反应为Ag+I――e-=AgI
C. 电位计读数越大O2含量越高 D. 部分AlI3固体变为Al2O3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)为__________反应(填“吸热”“放热”)。
2SO3(g)为__________反应(填“吸热”“放热”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
③V2O5可作为2SO2(g)+O2(g)![]() 2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①由图1信息,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”,下同);增加氮气的物质的量,则n(N2)的变化曲线为________。
②由图2信息,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,T2____T1(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,气缸体积一定,内部被活塞隔成ABC三部分,活塞可以自由移动。常温下,A中充入4g氢气, B中充入16g氧气,C中充入4g氦气。
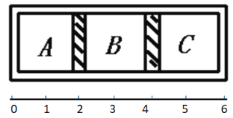
(1)当活塞不移动时,求A、B、C三部分体积比VA:VB:VC。____
(2)拿走A和B之间的活塞,让氢气和氧气充分混合用电火花点燃,恢复到原来的温度,通过计算,判断活塞停止的位置。(用线上数字表示)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的一组是
A. H和D互为同位素 B. 丁烯和环丁烷互为同分异构体
C. 碳链![]() 与
与 ![]() 的烃为同系物 D. 金刚石、石墨和C60为同素异形体
的烃为同系物 D. 金刚石、石墨和C60为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来一种“锌+碘”新型安全动力电池,亮相工博会高校展区。“锌+碘”新型安全动力电池有望取代目前广泛使用的“铅蓄电池”、“锂电池”等,已知该电池的工作原理如图所示。下列有关说法错误的是

A. 该电池安全性高,且对环境友好
B. 正极反应式为I3-+2e-=3I-,电极a附近显红色
C. 电子的移动方向为“Zn→电极a→电极b→石墨毡”
D. “回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com