
 实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:
实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:分析 实验室制备1,2-二溴乙烷:三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷.
(1)a.水浴加热的温度不得超过100℃,该反应的温度为170℃;
b.A中用酒精和浓硫酸制取乙烯时,浓硫酸的体积和酒精体积的比为3:1;
c.如果D中导气管发生堵塞事故,装置B中长导管液面会上升;
d.浓硫酸具有强氧化性,可能氧化乙醇中的碳;
e.乙烯与溴反应时放热,冷却可避免溴的大量挥发,但不能过度冷却(如用冰水),否则使气路堵塞;
(2)乙烯和溴水发生了加成反应;
(3)因Br2能与NaOH溶液反应,且1,2-二溴乙烷与水互不相溶,所以用氢氧化钠溶液吸收Br2,振荡后静置,产物应在下层;
(4)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发或气流速度过快.
解答 解:(1)a.三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,反应为温度为170℃,远超过水的沸点,无法采取水浴加热,故a错误;
b.浓H2SO4在该反应中除了起催化作用外,还起脱水作用,保持其过量的原因主要是为了使浓H2SO4保持较高的浓度,促使反应向正反应方向进行,
无水乙醇与浓硫酸的体积比为1:3,故b错误;
c.如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,故c正确;
d.浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,SO2+2NaOH═Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,所以C的目的是吸收反应中可能生成的酸性气体,故d正确;
e.溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,(如用冰水),所以D应用冷水冷却,但又不能过度冷却(如用冰水),故e正确;
故答案为:cde;
(2)该制备反应已经结束,装置D在乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以通过观察溴水颜色是否褪尽,判断装置D中该制备反应是否已经结束,
故答案为:D中褪色;
(3)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,
故答案为:NaOH;下;
(4)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发或气流速度过快,
故答案为:有副反应发生或气流速度过快.
点评 本题考查化学实验方案的评价、卤代烃的制备实验,为高频考点,涉及混合物分离提纯、有机物的结构与性质、实验条件控制、对操作分析评价等,把握物质的性质、反应原理、实验技能为解答的关键,注意实验的评价性分析,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10.0g | B. | 15.0g | C. | 16.7g | D. | 18.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
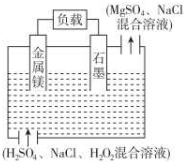 镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )
镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )| A. | 镁作该电源负极,发生反应Mg-2e-═Mg2+ | |
| B. | 该电池反应方程式:Mg+H2O2+2H+═Mg2++2H2O | |
| C. | 放电时溶液中的Cl-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com