
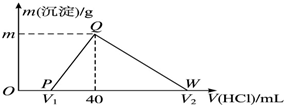
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )| A. | OP段发生的反应为:OH-+H+═H2O | B. | 图中V2为100 | ||
| C. | 沉淀的质量m为1.56 g | D. | 原合金质量为0.92 g |
分析 钠铝合金置于水中,合金全部溶解,发生反应:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,得到20mL pH=14的溶液,则溶液中c(OH-)=1mol/L,NaOH有剩余,剩余NaOH为0.02L×1mol/L=0.02mol;
开始加入盐酸没有立即产生沉淀,首先发生反应:NaOH+HCl═NaCl+H2O,该阶段消耗盐酸为:$\frac{0.02mol}{1mol/L}$=0.02L=20mL;
然后发生反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl),该阶段消耗盐酸体积为40mL-20mL=20mL,根据方程式计算n[Al(OH)3],根据铝元素守恒n(Al)=n[Al(OH)3];
最后发生反应:Al(OH)3↓+3HCl═AlCl3+3H2O,根据氢氧化铝的物质的量计算该阶段消耗盐酸的体积,据此进行解答.
解答 解:钠铝合金置于水中,合金全部溶解,发生反应为:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,得到20mL pH=14的溶液,则溶液中c(OH-)=1mol/L,NaOH有剩余,剩余NaOH为:0.02L×1mol/L=0.02mol;
开始加入盐酸没有立即产生沉淀,首先发生反应:NaOH+HCl═NaCl+H2O,该阶段消耗盐酸为:$\frac{0.02mol}{1mol/L}$=0.02L=20mL;
然后发生反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl)=0.04L×1mol/L=0.04mol,该阶段消耗盐酸体积为:40mL-20mL=20mL,根据方程式可知n[Al(OH)3]=n(HCl)=0.02L×1mol/L=0.02mol,根据铝元素守恒n(Al)=n[Al(OH)3]=0.02mol,
最后发生反应:Al(OH)3↓+3HCl═AlCl3+3H2O,消耗盐酸的物质的量为0.02mol×3=0.06mol,故该阶段消耗的盐酸体积为:$\frac{0.06mol}{1mol/L}$=0.06L=60mL,
A.OP段发生反应:NaOH+HCl═NaCl+H2O,离子方程式为:OH-+H+═H2O,故A正确;
B.由上述计算可知,溶解氢氧化铝消耗盐酸的体积为60mL,则V2为40mL+60mL=100mL,故B正确;
C.由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故C正确;
D.由上述分析可知,Na、Al合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故D错误;
故选D.
点评 本题考查离子反应的计算、混合物的有关计算,题目难度中等,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,注意利用元素守恒的方法来解答,试题培养了学生的分析、理解能力及化学计算能力.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 由多种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键 分子间作用力 非极性键 | |
| B. | 氢键 极性键 分子间作用力 | |
| C. | 氢键 氢键 极性键 | |
| D. | 分子间作用力 氢键 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更少 | |
| B. | 加水稀释到原体积的10倍后溶液pH变为4 | |
| C. | 加入少量乙酸钠固体,溶液pH升高 | |
| D. | 升高温度,溶液中所有离子浓度均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数是原子核外电子层数的2倍 |
| Y | 最高价氧化物既能与强酸反应,又能与强碱反应 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最高价氧化物的水化物为无机酸中最强的酸 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
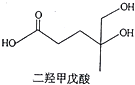 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com