
| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
分析 短周期非金属元素X和Y能形成XY2型化合物,则X可能为第ⅡA、第ⅣA族元素,Y可能为第ⅤⅡA、第ⅥA族元素,还有可能为NO2、SO2,并利用常见物质的性质来解答.
解答 解:短周期非金属元素X和Y能形成XY2型化合物,则X可能为第ⅡA、第ⅣA族元素,Y可能为第ⅤⅡA、第ⅥA族元素,还有可能为SO2,
A.如为MgCl2等化合物,在为离子化合物,故A错误;
B.如为CO2,则电子式为 ,故B正确;
,故B正确;
C.如为MgCl2等,则溶液呈中性,如为CO2、NO2、SO2,则溶液呈酸性,不可能呈碱性,故C正确;
D.由以上分析可知X可能是ⅣA、ⅤA或ⅥA族元素,故D正确.
故选A.
点评 本题考查XY2型化合物,学生熟悉常见的XY2型化合物及化合物的性质是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
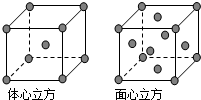 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
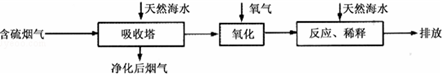
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 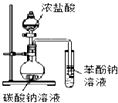 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. | 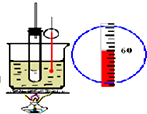 如图实验室制硝基苯 | |
| C. | 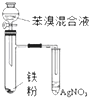 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 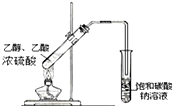 如图实验室制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.25mol/L CaCl2溶液 | B. | 50ml 1mol/L KCl溶液 | ||
| C. | 50ml 0.5mol/L NaCl溶液 | D. | 200mL 0.25mol/L AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com