
| A. | 3g H2 | B. | 11.2L HCl | C. | 1.12L H2O | D. | 3.01×1023个CH4 |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算氢气、HCl、甲烷分子物质的量,根据m=ρV计算水的质量,再计算其物质的量,结合分子含有H原子数目计算H原子物质的量.
解答 解:A.3g H2的物质的量为$\frac{3g}{2g/mol}$=1.5mol,含有H原子物质的量为1.5mol×2=3mol;
B.标况下11.2L HCl的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有H原子物质的量为0.5mol×1=0.5mol;
C.水的质量约是1.12L×1000g/L=1120g,含有H原子物质的量为$\frac{1120g}{18g/mol}$×2=62.2mol;
D.3.01×1023个CH4分子含有H原子物质的量$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$×4=2mol,
故1.12L H2O含有H原子数目最多,
故选C.
点评 本题考查微粒数目的计算,熟练掌握以物质的量为中心的计算,注意气体摩尔体积的使用条件与对象.


科目:高中化学 来源: 题型:解答题
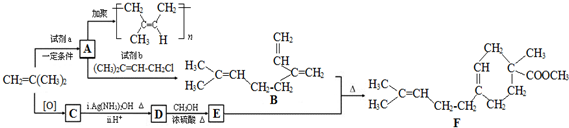
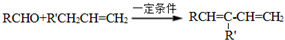
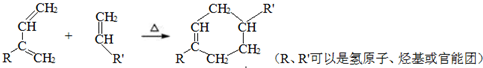
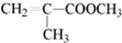 .
.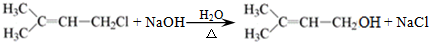 .
.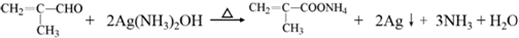 .
.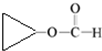 .
.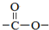 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
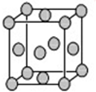 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题. .填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).
.填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).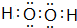 ,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
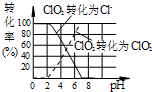 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com